
| 5×V(KMnO4)×c(KMnO4) |
| 2 |
| 250 |
| 25 |
| 25×V(KMnO4)×c(KMnO4)×126g/mol |
| W |
| 3.15V(KMnO4)×c(KMnO4) |
| W |
| 3.15V(KMnO4)×c(KMnO4) |
| W |


科目:高中化学 来源: 题型:
| A、K+ Na+ HCO3- NO3- |
| B、Na+ SO42-Cl- ClO- |
| C、H+ Mg2+ SO42- NO3- |
| D、Ag+ K+ NO3- Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁溶液腐蚀铜箔:Fe3++Cu=Fe2++Cu2+ | ||||
| B、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO2↑+H2O | ||||
C、电解饱和食盐水:2Cl-+2H2O
| ||||
| D、SO2通入足量的氨水中:SO2+NH3+H2O═NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
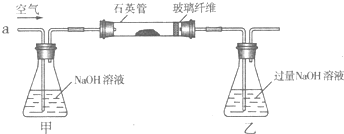 【化学--选修2化学与技术】
【化学--选修2化学与技术】
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):
已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
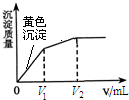 向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )
向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )| A、该实验可以证明AgI比AgCl更难溶 |
| B、加入V2 mL AgNO3溶液后,溶液中不含I- |
| C、V1=V2-V1 |
| D、向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①研究的是电解CuCl2溶液,b电极上有红色固体析出 |
| B、装置②研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e-=Fe2+ |
| C、装置③研究的是电解饱和食盐水,B电极发生的反应:2Cl--2e-=Cl2↑ |
| D、三个装置中涉及的主要反应都是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com