
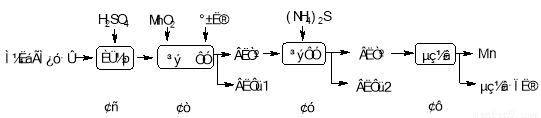
(本题共16分)锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。为了将Mn2+降到1.0×10-9mol/L,则c(Na2S)至少是 mol/L。
(1)MnCO3+H2 SO4 =MnSO4+ CO2↑+H2O(3分)
(2)MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O (3分)(3)CoS和NiS (3分,错、漏均扣1分)
(4)阴(1分),Mn2++2e- =Mn (3分)(5)1.0×10-2 (3分)
【解析】
试题分析:(1)硫酸是强酸与碳酸锰反应生成硫酸锰、水和CO2,反应的化学方程式为MnCO3+H2 SO4 =MnSO4+ CO2↑+H2O。
(2)MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,而二氧化锰的还原产物是锰离子,反应的离子方程式是MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O。
(3)加氨水后除去了铁离子,溶液中的金属阳离子主要是锰离子、钴离子和镍离子,因此加入硫化铵后主要是生成CoS和NiS,即滤渣2的主要成分是CoS和NiS。
(4)锰离子得到电子被还原为单质锰,电解池中阴极得到电子被还原,所以在阴极析出Mn,电极反应方程式为Mn2++2e- =Mn。
(5)根据硫化锰的溶度积常数可知,当Mn2+降到1.0×10-9mol/L时,溶液中硫离子的浓度为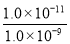 =0.01mol/L,即c(Na2S)至少是0.01mol/L。
=0.01mol/L,即c(Na2S)至少是0.01mol/L。
考点:考查金属锰工业生产流程的有关判断


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:选择题
下列关于碳酸钠和碳酸氢钠的说法不正确的是
A.碳酸钠的热稳定性比碳酸氢钠强
B.相同温度时,碳酸钠的溶解度大于碳酸氢钠
C.同温度、同物质的量浓度时,碳酸钠溶液碱性大于碳酸氢钠溶液
D.碳酸氢钠一定条件下可转化为碳酸钠,但碳酸钠不能转化为碳酸氢钠
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
书法离不开文房四宝(笔、墨、纸、砚),做笔用的狼毫,研墨用的墨条以及宣纸(即白纸)和做砚台用的砚石的主要成份依次是
A.多糖、石墨、蛋白质、无机盐
B.塑料、石墨、多糖、无机盐
C.蛋白质、炭黑、多糖、无机盐
D.蛋白质、煤炭、多糖、有机玻璃
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
以下反应最符合绿色化学原子经济性要求的是
A.乙烯聚合为聚乙烯高分子材料
B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜
D.用SiO2制备高纯硅
查看答案和解析>>
科目:高中化学 来源:2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷(解析版) 题型:选择题
已知图①~④的相关信息,下列相应叙述正确的是 ( )
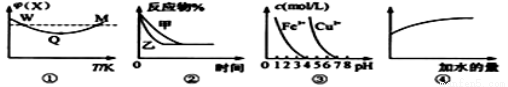
A.图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)  3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率
3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率
B.图②表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强小
3C(g)+D(s)的影响,乙的压强比甲的压强小
C.据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右
D.常温下,稀释0.1mol/LNa2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省雅安市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
440℃时2SO2(g) + O2(g) 2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
| 甲 | 乙 | 丙 | |
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 | 80% | α1 | α2 | |
下列判断中,错误的是
A.甲中SO2的速率为0.032mol·L-1·min-1 B.440℃时,平衡常数K=400
C.温度高于440℃时,平衡常数K>400 D.平衡时,SO2的转化率:α1<80%<α2
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:填空题
(11分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题:
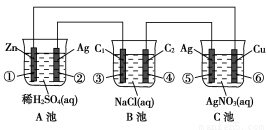
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( )
A.2H++2e-=H2 ↑ B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超重
元素,该元素原子核内中子数与核外电子数之差是( )
A.57 B.47 C.61 D.293
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com