
 ×100%=
×100%= ×100%=77.8%.
×100%=77.8%. =
=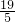 ,
,

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
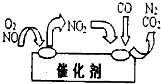 工业上利用氨催化氧化后,经过一系列反应可以制备硝酸.
工业上利用氨催化氧化后,经过一系列反应可以制备硝酸.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(17分)实验室中有三瓶失去标签的酸,分别是浓硫酸、浓盐酸和浓硝酸。
(1)有同学认为,用金属铜做试剂可鉴别上述三种酸,请用化学方程式和必要的文字加以说明。____________________________________________________________________。
(2)请设计一个实验装置,使铜与稀硫酸反应生成硫酸铜与氢气。在下面的方框内画出装置图,并标明电极材料名称和电解质溶液名称。
(3) 实验室中欲用浓硫酸配制2.0mol·L-1的稀硫酸500mL。
①实验过程中所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有____________________;
②下列操作中造成所配溶液浓度偏低的是_____________。
a.用量筒量取浓硫酸时仰视刻度线
b.定容时俯视刻度线
c.转移溶液后未洗涤烧杯和玻璃棒就直接定容
d.定容后摇匀,发现液面低于刻度,未补加蒸馏水至刻度
(4)下图所示为实验室模拟工业上利用氨催化氧化法制备硝酸的实验
用装置A制备干燥氨气,装置B制备干燥氧气。
①装置A的试管中发生反应的化学方程式为_______________________________ 。
装置B的烧瓶内发生反应的化学方程式为__________________________________。
②下列关于A、B装置的叙述不正确的是__________
a.若选择合适的试剂,用B装置也可制备氨气
b.实验过程中,A、B装置中一定有一个发生氧化还原反应
c.U形管中的试剂可以相同,但作用不相同
③按照a接c,b接d的顺序连接装置进行实验。
玻璃管内发生反应的化学方程式为___________________________________。
实验结束后,某同学测得装置C中试管内所得溶液的pH<7,得出的结论为该溶液一定是硝酸。该结论__________(填“严密”或“不严密”),你的理由是_____________________________。
查看答案和解析>>
科目:高中化学 来源:江苏省2011届高三化学一轮过关测试(3) 题型:计算题
(11分)工业上利用氨催化氧化法可制取硝酸,加入脱水剂后制得较高浓度的硝酸。现以17吨氨作为原料,假设NH3全部转化为HNO3。
(1)写出NH3完全转化为HNO3的总化学反应方程式
(2)生产过程中需加水吸收,如果加入脱水剂后脱去水的量相等,则所得硝酸溶液的质量分数为多少?
(3)如果生产中同时制得50%的硝酸m1吨和90%的硝酸m2吨(脱去的水可循环使用,制得教低浓度的稀硝酸),若共加入27吨水,则m1与m2的质量比为多少?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济南市高三12月月考化学试卷 题型:实验题
(17分)实验室中有三瓶失去标签的酸,分别是浓硫酸、浓盐酸和浓硝酸。
(1)有同学认为,用金属铜做试剂可鉴别上述三种酸,请用化学方程式和必要的文字加以说明。____________________________________________________________________。
(2)请设计一个实验装置,使铜与稀硫酸反应生成硫酸铜与氢气。在下面的方框内画出装置图,并标明电极材料名称和电解质溶液名称。

(3) 实验室中欲用浓硫酸配制2.0mol·L-1的稀硫酸500mL。
①实验过程中所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有____________________;
②下列操作中造成所配溶液浓度偏低的是_____________。
a.用量筒量取浓硫酸时仰视刻度线
b.定容时俯视刻度线
c.转移溶液后未洗涤烧杯和玻璃棒就直接定容
d.定容后摇匀,发现液面低于刻度,未补加蒸馏水至刻度
(4)下图所示为实验室模拟工业上利用氨催化氧化法制备硝酸的实验

用装置A制备干燥氨气,装置B制备干燥氧气。
①装置A的试管中发生反应的化学方程式为_______________________________ 。
装置B的烧瓶内发生反应的化学方程式为__________________________________。
②下列关于A、B装置的叙述不正确的是__________
a.若选择合适的试剂,用B装置也可制备氨气
b.实验过程中,A、B装置中一定有一个发生氧化还原反应
c.U形管中的试剂可以相同,但作用不相同
③按照a接c,b接d的顺序连接装置进行实验。
玻璃管内发生反应的化学方程式为___________________________________。
实验结束后,某同学测得装置C中试管内所得溶液的pH<7,得出的结论为该溶液一定是硝酸。该结论__________(填“严密”或“不严密”),你的理由是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com