
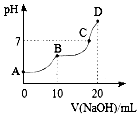
 25℃时,向10mL 0.1mol•L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述错误的是( )
25℃时,向10mL 0.1mol•L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述错误的是( )| A. | C点溶液中含有NaHA和Na2A | |
| B. | NaHA溶液中水的电离程度比Na2A溶液中小 | |
| C. | B点,c (Na+)=2[c (H2A)+c (HA)+c (A2-)] | |
| D. | D点,c (Na+)>c (A2-)>c (OH-)>c (HA-)>c (H+) |
分析 25℃时,向10mL 0.1mol•L-1 H2A溶液中滴加等浓度的NaOH溶液发生反应,当滴入20ml恰好完全反应生成Na2A溶液,溶液显碱性,当溶液PH=7溶液中存在Na2A溶液和H2A溶液,当加入氢氧化钠溶液体积10ml,反应为H2A+NaOH=NaHA+H2O,溶液PH<7显酸性,说明HA-电离程度大于其水解程度,据此分析选项.
解答 解:A.当溶液PH=7溶液中存在Na2A溶液和H2A溶液,A2-离子水解生成HA-,C点溶液中含NaHA和Na2A,故A正确;
B.当加入氢氧化钠溶液体积10ml,反应为H2A+NaOH=NaHA+H2O,溶液PH<7显酸性,说明HA-电离程度大于其水解程度,NaHA溶液中水的电离程度比Na2A溶液中小,故B正确;
C.B点为NaHA溶液,溶液中存在物料守恒,c (Na+)=c (H2A)+c (HA)+c (A2-),故C错误;
D.D点是Na2A溶液,A2-离子分布水解溶液显碱性,离子浓度大小为:c (Na+)>c (A2-)>c (OH-)>c (HA-)>c (H+),故D正确;
故选C.
点评 本题考查离子浓度大小比较、溶液酸碱性与溶液pH的计算,题目难度中等,明确图象曲线对应溶质为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Al3+$\stackrel{过量氨水}{→}$AlO${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| D. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq) $\stackrel{NaOH(aq)}{→}$Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的H2SO4与pH=12的NaOH等体积混合,所得溶液呈酸性 | |
| B. | 0.1mol/L的CH3COOH溶液在加水稀释过程中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$减小 | |
| C. | pH=5的NaHSO4溶液中水的电离程度小于纯水的电离程度 | |
| D. | 0.1mol/L的NaHCO3溶液中:c(OH-)═(H+)+2c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
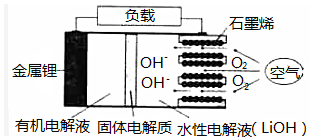 新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过.下列说法正确的是( )
新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过.下列说法正确的是( )| A. | 放电时,负极反应式:Li-e-+OH-═LiOH | |
| B. | 放电时,当外电路中有1mole-转移时,水性电解液离子总数增加NA | |
| C. | 应用该电池电镀铜,阴极质量增加64g,理沦上将消耗11.2LO2 | |
| D. | 若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
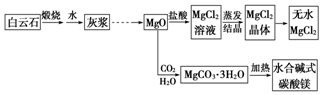 碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:
碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+═SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量的二氧化碳:Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com