
分析 (1)①将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04),结合原子守恒配平书写化学方程式;
②电解锰酸钾(K2Mn04)溶液,得到高锰酸钾,结合锰元素化合价变化+6价变化为+7价,失电子发生氧化还原反应,阴极上是溶液中氢离子得到电子生成氢气;
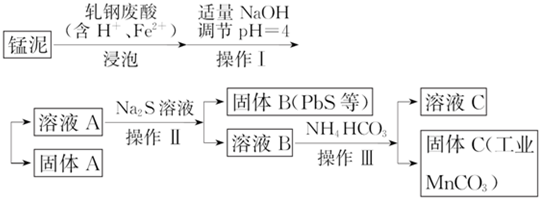
(2)猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),锰泥和轧钢废液浸泡,其中轧钢废酸中Fe2+的作用是还原K2Mn04、Mn02为锰离子,加入适量氢氧化钠调节溶液PH=4,过滤得到溶液A和固体A,溶液A中加入硫化钠溶液反应得到固体B为PbS沉淀,滤液B加入碳酸氢铵溶液过滤得到固体C碳酸锰;
①亚铁离子具有还原性还原锰元素为锰离子;
②分析流程操作ⅠⅡⅢ都是分离固体和液体的操作,用 过滤操作分离;
③溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是K+、Na+、NH4+;
④依据碳酸钙和碳酸锰共存,结合溶度积常数计算分析.
解答 解:(1)①将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04),结合原子守恒配平书写化学方程式为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;
②电解锰酸钾(K2Mn04)溶液,得到高锰酸钾,结合锰元素化合价变化+6价变化为+7价,失电子发生氧化还原反应,所以在阳极区发生反应;阴极上是溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,
故答案为:阳极区;2H++2e-=H2↑;
(2)猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),锰泥和轧钢废液浸泡,其中轧钢废酸中Fe2+的作用是还原K2Mn04、Mn02为锰离子,加入适量氢氧化钠调节溶液PH=4,过滤得到溶液A和固体A,溶液A中加入硫化钠溶液反应得到固体B为PbS沉淀,滤液B加入碳酸氢铵溶液过滤得到固体C碳酸锰;
①轧钢废酸中Fe2+的作用是,亚铁离子具有还原性,还原锰元素为锰离子;
故答案为:将高价的锰元素还原成Mn2+;
②分析流程操作ⅠⅡⅢ都是分离固体和液体的操作,用过滤操作分离;
故答案为:过滤;
③依据流程和加入的试剂分析判断,溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是K+、Na+、NH4+;
故答案为:K+、Na+、NH4+;
④依据碳酸钙和碳酸锰共存,结合溶度积常数计计算,则溶液C中$\frac{c(Ca{\;}^{2+})}{c(Mn{\;}^{2+})}$=$\frac{Ksp(CaCO{\;}_{3})}{Ksp(MgCO{\;}_{3})}$=$\frac{5×10{\;}^{-9}}{1×10{\;}^{-11}}$=500,若固体C中不含CaCO3,则溶液C中$\frac{c(C{a}^{2+})}{c(M{n}^{2+})}$<500;
故答案为:500.
点评 本题考查了流程分析,实验基本操作方法,电解原理 分析判断,溶度积常数计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
已知某物质X的熔点为-83 ℃,沸点为77 ℃,不溶于水,密度小于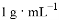 。要从水与X的混合物中简便快捷地分离出X,需要用到的仪器是
。要从水与X的混合物中简便快捷地分离出X,需要用到的仪器是
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
A.在同温同压下,相同体积的任何气体单质所含的分子数目一定相同
B.1L 0.5mol/L FeCl3溶液完全转化可得0.5NA个Fe(OH)3胶粒
C.标准状况下,22.4L苯含有的分子数为1NA
D.在常温常压下,11.2 L氮气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
汞(熔点-39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。

下列分析错误的是
A.“灼烧辰砂法”过程中电子转移的方向和数目可表示为:
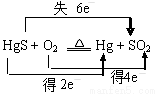
B.辰砂与氧化钙加热反应时,CaSO4为氧化产物
C.洗涤粗汞可用5%的盐酸代替5%的硝酸
D.减压蒸馏的目的是降低汞的沸点,提高分离效率
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
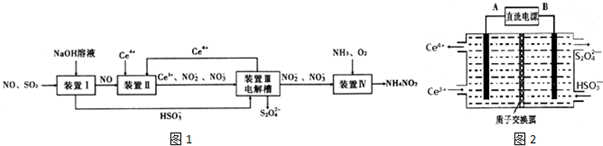
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:$\frac{1}{2}$ amol≤n≤$\frac{5}{6}$amol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
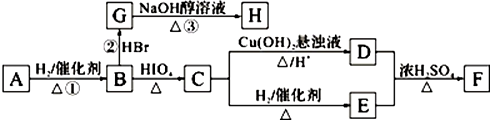
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重结晶是利用混合物中各组分在某种溶剂中的溶解度不同而使它们相互分离的方法 | |
| B. | 蒸馏时,如果温度计水银球的位置偏高,会导致得到的馏分的沸点偏低 | |
| C. | 在氢氧化镁悬浊液中加入氯化铵溶液,悬浊液溶解证明了氯化铵溶液水解呈酸性 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com