
����Ŀ��������Ԫ��A��B��C��D��E��ԭ����������������Ԫ��������Ϣ�����
Ԫ�ر�� | Ԫ��������Ϣ |
A | ������ۺ�����۵ľ���ֵ֮��Ϊ2 |
B | ��Eͬ���� |
C | lmo1C����������ˮ��Ӧ���ڱ�״��������11.2LH2 |
D | ԭ�������������������������� |
E | ��һ�������ӵĵ��Ӳ�ṹ��Arԭ����ͬ |
��1�� A�����ڱ��е�λ��Ϊ ��
��2��B��C�γɵĻ�����ĵ���ʽΪ ��
��3��B��D�����ӵİ뾶��СΪ ��
��4��Ԫ�طǽ�����ǿ���Ƚ��кܶ��������B��E�ķǽ�����ǿ�����о������в����е��� (�����)��
A���Ƚ����ֵ��ʵ���ɫ
B���Ƚ����ֵ�����H2���ϵ����׳̶�
C��������Ԫ�������ڱ��е�λ��
D���Ƚ϶�Ӧ�����ӵĻ�ԭ��
e.�Ƚ�����������Ӧˮ���������
��5��EԪ��������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����Է�������Ϊ120.5��������ʵĻ�ѧʽΪ ��
���𰸡���1���ڶ����ڵ���A�壻��2��![]() ����3��F->Al3+����4��a��e����5��NCl3��
����3��F->Al3+����4��a��e����5��NCl3��
�����������������������Ԫ��A��B��C��D��E��ԭ��������������A��������ۺ�����۵ľ���ֵ֮��Ϊ2����A���������Ϊ+5������Ϊ-3������AΪ��A��Ԫ�أ����ԭ��������С��֪AΪNԪ�أ�1molC����������ˮ��Ӧ���ڱ�״��������11.2LH2�����������ʵ���Ϊ��11.2L��22.4L/mol=0.5mol����1molC��ȫ��Ӧʧȥ1mol���ӣ���CΪNaԪ�أ�D��ԭ����������������������������D��ԭ����������Na����DΪ�������ڵ���A��Ԫ�أ�ΪAlԪ�أ�E�ĸ�һ�������ӵĵ��Ӳ�ṹ��Arԭ����ͬ����������Ϊ18-1=17������EΪClԪ�أ�B��Eͬ���壬��BΪFԪ�ء���1�� A��NԪ�أ������ڱ��е�λ��Ϊ�ڶ����ڵ���A�壻��2��BΪFԪ�ء�CΪNaԪ�أ������γɵ������ӻ��������ʽ�ǣ�![]() �� ��3�� BΪFԪ�ء�DΪAlԪ�أ������Ӻ������Ӷ�������ͬ�ĺ�������Ų����˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��СΪ��F-��Al3+����4�� B��FԪ�أ�E��ClԪ�أ�A������ͨ���Ƚ����ֵ��ʵ���ɫ�ж�Ԫ�صķǽ����Ե�ǿ��������B��Ԫ�صķǽ�����Խǿ���䵥�����������Ͼ�Խ���ף����Կ���ͨ���Ƚ����ֵ�����H2���ϵ����׳̶��ж�Ԫ�صķǽ����Ե�ǿ������ȷ��C��Ԫ��ԭ�Ӻ�����Ӳ���Խ�࣬Ԫ�صķǽ����Ծ�Խ�������Կ���������Ԫ�������ڱ��е�λ�ã��ж�Ԫ�صķǽ����Ե�ǿ������ȷ��D�����ӵĻ�ԭ��Խǿ����Ԫ�صķǽ����Ծ�Խ�������Կ��ԱȽ϶�Ӧ�����ӵĻ�ԭ���ж�Ԫ�صķǽ����Ե�ǿ������ȷ��e.һ������£�Ԫ�صķǽ�����Խǿ������ۺ����������Խǿ��������F�Ƿǽ�������ǿ��Ԫ�أ������γɺ��������Բ���ͨ���Ƚ�����������Ӧˮ����������ж�F��Cl�ǽ����Ե�ǿ��������5��EԪ����ClԪ�أ�������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����Է�������Ϊ120.5������CԪ�صĻ��ϼ�Ϊ-1�ۣ�������һ��Ԫ�ػ��ϼ���+3�ۣ������Է���������֪��Ԫ��ΪNԪ�أ��û�����Ļ�ѧʽΪ��NCl3��
�� ��3�� BΪFԪ�ء�DΪAlԪ�أ������Ӻ������Ӷ�������ͬ�ĺ�������Ų����˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��СΪ��F-��Al3+����4�� B��FԪ�أ�E��ClԪ�أ�A������ͨ���Ƚ����ֵ��ʵ���ɫ�ж�Ԫ�صķǽ����Ե�ǿ��������B��Ԫ�صķǽ�����Խǿ���䵥�����������Ͼ�Խ���ף����Կ���ͨ���Ƚ����ֵ�����H2���ϵ����׳̶��ж�Ԫ�صķǽ����Ե�ǿ������ȷ��C��Ԫ��ԭ�Ӻ�����Ӳ���Խ�࣬Ԫ�صķǽ����Ծ�Խ�������Կ���������Ԫ�������ڱ��е�λ�ã��ж�Ԫ�صķǽ����Ե�ǿ������ȷ��D�����ӵĻ�ԭ��Խǿ����Ԫ�صķǽ����Ծ�Խ�������Կ��ԱȽ϶�Ӧ�����ӵĻ�ԭ���ж�Ԫ�صķǽ����Ե�ǿ������ȷ��e.һ������£�Ԫ�صķǽ�����Խǿ������ۺ����������Խǿ��������F�Ƿǽ�������ǿ��Ԫ�أ������γɺ��������Բ���ͨ���Ƚ�����������Ӧˮ����������ж�F��Cl�ǽ����Ե�ǿ��������5��EԪ����ClԪ�أ�������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����Է�������Ϊ120.5������CԪ�صĻ��ϼ�Ϊ-1�ۣ�������һ��Ԫ�ػ��ϼ���+3�ۣ������Է���������֪��Ԫ��ΪNԪ�أ��û�����Ļ�ѧʽΪ��NCl3��


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M���ӵ����ģ����ͼ��ʾ����AΪԭ�Ϻϳ�B��M��·�����£�

��֪��A����Է�������Ϊ26��
��1��A������Ϊ____________ ��M�ķ���ʽΪ____________��
��2����״��B�ĺ˴Ź���������ֻ��һ�ַ壬����ʹ������Ȼ�̼��Һ��ɫ����B�Ľṹ��ʽΪ____________��
��3����1molE��ȫת��ΪFʱ����Ҫ____________ molNaOH��
��4��G�еĺ��������ŵ�������____________��д����G��Ӧ���ɸ߷��ӵĻ�ѧ��Ӧ����ʽ��____________��
��5��M��ͬ���칹���ж��֣����������������ͬ���칹�干��____________����
���ܷ���������Ӧ �����б����ұ�����һ��ȡ����������
����FeCl3��Һ������ɫ
��1mol���л����������Ʒ�Ӧ����1mol����(һ��̼ԭ����ͬʱ��������-OH���ȶ�)
������һЩ���������ɵ���Ԫȩ��д������һ�ֵĽṹ��ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪͭ˿��Ũ���ᷴӦ����֤��������ʵ�ʵ��װ�á�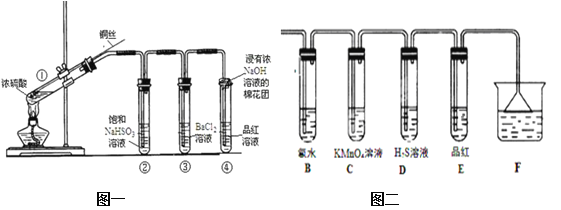
��1�����з�Ӧ�Ļ�ѧ����ʽ�� ������ͭ������ (���������ԭ��)��Ӧ���ж�����Ϊ _______________ ��
��2��Ũ�����ڴ˷�Ӧ��������_________�Ժ�____________�ԡ�
��3�����б���NaHSO3��Һ�������dz�ȥ���лӷ��������ᡣ����һ��ʱ���������Һ��Ȼ���壬������Һ��ɫ����Ҫ������ֹͭ������ķ�Ӧ����ǡ���ķ����� _____________��
a������ͭ˿��ʹ���������� b����ȥ�ƾ��� c����ȥ������������
��4����Ӧֹͣ��װ����ȴ����������Һ����NaOH��Һ���۲쵽��������__________��
��5���������ŵ������� ____ ��
��6������Ũ������ͭ��Ӧ�����������ͨ��ͼ����װ��������Ӧ��װ��B�з����������� ����Ӧ�Ļ�ѧ����ʽΪ ______________________��װ��C�е������� ��������SO2�� �ԣ�װ��D�������� ��������SO2�� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
��1���ҹ�ij������̽���̲��зḻ�ij�����(��Ҫ�ɷ�ΪFe2O3��������SiO2������)��ú��ʯ��ʯ����������ڸõ������������������
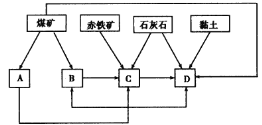
����������Ŀ������������Ľ�������Ҫ�ڸõ�����Ӧ���������������糧��ˮ�೧�ȣ��γɹ�ģ�Ĺ�ҵ��ϵ���ݴ�ȷ��ͼ����Ӧ���������ƣ�A��________��B��________��C��________��D��________��
���Գ�����Ϊԭ�ϣ�д����¯�����еõ������Ͳ���¯���Ļ�ѧ����ʽ��
__________________________________________________________��
��
��2�������ֿ��ɷ�ȩ��֬�Ͳ�����ά�Ƴɡ�
�ٷ�ȩ��֬�ɷ�ȩ�ͼ�ȩ���۶��ɣ���Ӧ�д����ȷų���Ϊ��ֹ�¶ȹ��ߣ�Ӧ���б��ӵķ�Ӧ��________�ؼ����ȩ���ҷ�Ӧ��Ӧװ��________װ�á�
�ڲ������в�����ά��������______�������־��� ���������ܣ�д�����㼴�ɣ���
�����д����Ͼ��ȹ��Է�ȩ���ϵ�������������________��
a������ b�������������֬����
c������ȼ�� d�����л��ܼ������ܽ⣬������֬
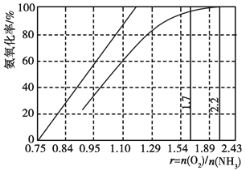
��3����ҵ����Ҫ���ð��������������ᣬ��ͼ�ǰ��������백������������������ȵĹ�ϵ������ֱ�߱�ʾ��Ӧ������ֵ�����߱�ʾ����ʵ����������������ʴﵽ100%��������r[n(O2)/n(NH3)]��________��ʵ������Ҫ��rֵά����1.7��2.2֮�䣬ԭ����___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���Լ���Ϊԭ����ʵ���������һ����̼�ͼ���ͭ�������ʵ��Ʊ�ʵ�顣
ʵ��һ���ü����Ʊ�һ����̼
CO���Ʊ�ԭ����HCOOH![]() CO��+H2O���Ʊ�װ������ͼ�����мг���������������û�л�����
CO��+H2O���Ʊ�װ������ͼ�����мг���������������û�л�����
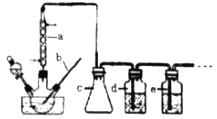
��1��b����������Ϊ___________��c��������___________��
��2���Ʊ�COʱ��Ũ���������Ļ�Ϸ�ʽ��___________��
ʵ������ü����Ʊ�����ͭ[Cu��HCOO��24H2O]
����һ����ʽ̼��ͭ���Ʊ�
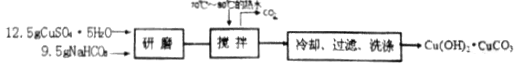
�����������ͭ���Ʊ�
����Ʒ��ʽ̼��ͭ�����ձ��ڣ�����Լ20mL����ˮ�����Ƚ�����323K���ң���μ�������������������ȫ�ܽ⣬���ȹ�������Һ��ͨ�����������ԭ�����![]() ���ң���ȴ�����£���ѹ���ˣ�ϴ�ӣ���Cu��HCOO��24H2O��Ʒ��������������ʡ��ش��������⣺
���ң���ȴ�����£���ѹ���ˣ�ϴ�ӣ���Cu��HCOO��24H2O��Ʒ��������������ʡ��ش��������⣺
��3�����Ʊ���ʽ̼��ͭ�Ĺ����У�����¶ȹ��ߣ��Բ����к�Ӱ�죿___________��
��4��������м�ʽ̼��ͭ�������������ˮ�ϼ���ͭ�Ļ�ѧ����ʽΪ___________��
��5����ʵ���漰���ֹ�Һ����ķ�����
��������ʹ�õ���������___________��
�����ü�ѹ���˵�װ�öԲ��������ܽ�����Һ���г��ȹ�����
����������ʵ���У����õ�����װ��___________

��6�����ճ������õIJ�ƷΪ7.91g�������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����������Ӧ����ʽΪ________________��

��2����NH3���������з�ȼ�ϵ���ǵ�ǰ���е�һ���ȵ㡣ʹ�õĵ������Һ��2molL��1��KOH��Һ������ܷ�ӦΪ��4NH3+3O2��2N2+6H2O���õ�ظ����ĵ缫��ӦʽΪ ��ÿ����3.4g NH3ת�Ƶĵ�����ĿΪ_________��
��3����NH3ȼ�ϵ�ص��CuSO4��Һ����ͼ��ʾ��A��B��Ϊ���缫��ͨ��һ��ʱ�����A�缫���к�ɫ������������B�缫�Ϸ����ĵ缫��ӦʽΪ ����ʱ��������Һ�м���8gCuO�����ǡ�ÿ�ʹ��Һ�ָ������ǰ��Ũ�ȣ�����������ռ����������ڱ�״�������Ϊ L��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����H2��I2(g)�����ܱ������н��з�Ӧ��H2��I2��g��![]() 2HI����Ӧ���е�2minʱ��÷�Ӧ���ʦԣ�HI��=0.1mol/��L��min����I2(g)�����ʵ���Ũ��Ϊ0.4mol/L��
2HI����Ӧ���е�2minʱ��÷�Ӧ���ʦԣ�HI��=0.1mol/��L��min����I2(g)�����ʵ���Ũ��Ϊ0.4mol/L��
��1����Ӧ���ʦԣ�I2���� ��
��2��2minδc(HI)�� mol/L��
��3����ʼʱ��c(H2)�� mol/L����Ӧ���е�2minʱ��������I2��ռ�����������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pC������pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ö����ĸ�ֵ����ij��Һ��ij���ʵ�Ũ��Ϊ1��10��3mol/L�������Һ�и����ʵ�pC����lg(1��10��3)��3����ͼΪ25��ʱH2CO3��Һ��pC��pHͼ(������Ũ��С��10-5mol/L������Ϊ�����Ӳ�����)������˵������ȷ����

A��ij�¶��£�CO2������Һ��Ũ����0.05 molL��1������1/5��CO2ת��ΪH2CO3������ʱ��Һ��pHԼΪ5���ݴ˿ɵø��¶���CO2������Һ��H2CO3�ĵ����Ϊ0.1% ��
B��25��ʱ��H2CO3һ������ƽ�ⳣ������ֵKa1=10��6
C����Na2CO3��Һ�еμ�������pH����11ʱ����Һ�У�c(Na+)+c(H+)=2c(CO32��)+c(OH��)+c(HCO3��)
D��25��ʱ��0.1mol/LNa2CO3��c(HCO3��)��0.1mol/LH2CO3��c(HCO3��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��;�㷺����ҵ�Ͽ�ͨ���������̺ϳɶ��ʴ������������֪��R-OH+SOC12=R-C1+SO2��+HC1������ش���

��1��д���й����ʵĽṹ��ʽ��A__________��D__________��
��2��ָ����Ӧ��������__________����__________��
��3��д�����л�ѧ����ʽ����Ӧ��__________����Ӧ��__________��
��4�����ʴ�����(��)�Ҷ�����.������ṹ�ж�����˵����ȷ����__________(�����)
A��������ˮB���е�ϸ�C������ȼ��D����������Ʒ�Ӧ
��5��E��ͬ���칹��ָܶ࣬��ͬʱ��������������ͬ���칹�����Ŀ��__________�֣�
��������״�ṹ���ǻ�����ֱ�����ڲ�����̼ԭ����
����������O=C=C������C=C=C���ṹ�������Ǹ��������칹
��д�������ܹ�����������Ӧ�������칹��Ľṹ��ʽ��__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com