
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.根据元素守恒知,即使碳酸钠分解也不能生成水;
B.原溶液中含有Fe3+,加入KSCN溶液,溶液呈红色;
C.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
D.NH4Cl受热分解为NH3与HCl,在试管口处冷却,NH3与HCl反应又得到NH4Cl固体.
解答 解:A.根据元素守恒知,即使碳酸钠分解也不能生成水,可能是碳酸钠不干燥导致的,故A错误;
B.原溶液中若含有Fe3+,加入KSCN溶液,溶液也会呈红色,不能说明原溶液中是否含有Fe2+,故B错误;
C.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,氯气具有强氧化性,能将碘离子氧化生成碘,碘遇淀粉试液变蓝色,加入淀粉后溶液变蓝色,说明碘离子被氧化生成碘单质,氧化剂是氯气、氧化产物是碘,所以氧化性氧化性:Cl2>I2,故C正确;
D.NH4Cl受热分解为NH3与HCl,在试管口处冷却,NH3与HCl反应又得到NH4Cl固体,不能说明NH4Cl固体可以升华,故D错误;
故选C.
点评 本题考查化学实验方案评价,涉及离子检验、氧化性强弱比较、物质性质等知识点,侧重考查学生分析判断能力,明确物质性质及基本原理是解本题关键,易错选项是D.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ③④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
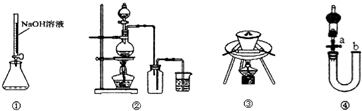
| A. | 用装置①量取15.00mL的NaOH溶液 | |
| B. | 用装置②制备并收集Cl2 | |
| C. | 用装置③陶瓷坩埚高温煅烧CaCO3固体 | |
| D. | 关闭活塞a,从b处加水,以检查装置④的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | 溶液BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com