
【题目】实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称___________,装置C中三颈瓶置于冰水浴中的目的是______________________。
(2)装置B吸收的气体是____________(写化学式),装置D的作用是____________________。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为____________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯______________________,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为_________ %(保留1位小数)。
【答案】分液漏斗 防止Cl2与KOH反应生成KClO3 HCl 吸收多余的Cl2,防止污染空气 3C1O-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O 置于冰水浴中,加入适量饱和KOH溶液 94.3
【解析】
由反应原理和实验装置图可知,A装置中用二氧化锰与浓盐酸加热制得氯气,氯气中有挥发出来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,为防止在较高温度下生成KClO3,C装置中用冰水浴,反应的尾气氯气用D装置中氢氧化钠吸收。
(1)根据装置图可知仪器a的名称是分液漏斗,Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以冰水浴的目的是防止Cl2与KOH反应生成KClO3,故答案为:分液漏斗;防止Cl2与KOH反应生成KClO3;
(2)氯气中有氯化氢需要除去,氯气有毒,需要进行尾气吸收,所以装置B吸收的气体是HCl,装置D的作用是吸收Cl2,防止污染空气,故答案为:HCl;吸收多余的Cl2,防止污染空气;
(3)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O,故答案为:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O;
(4)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥,故答案为:置于冰水浴中,加入适量饱和KOH溶液;
(5)根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,根据题意可知,(NH4)2Fe(SO4)2的物质的量为0.03L×0.01000mol/L=0.0003mol,所以高铁酸钾的质量为0.0003mol×![]() ×198g/mol×10=0.198g,所以K2FeO4样品的纯度为
×198g/mol×10=0.198g,所以K2FeO4样品的纯度为![]() ×100%=94.3%,故答案为:94.3。
×100%=94.3%,故答案为:94.3。


科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 实验室用氯化铵和熟石灰制氨:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. NaOH溶液与NH4Cl溶液混合加热:NH4+ +OH-![]() NH3·H2O
NH3·H2O
C. 氨水中加盐酸:NH3·H2O+H+=NH4++H2O
D. 氨水中加入氯化铁溶液:Fe2++2NH3·H2O=2NH4++Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应2A(?)+B(g)![]() 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:

(1)物质A的状态是_________(填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是_____;
(3)v(a)、v(b)、v(c)按由大到小排序_________________;
(4)对于2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是___________;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率__________(填“会”或“不会”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生产、生活中都有重要的应用:

(Ⅰ)现实验室要配置一定物质的量浓度的稀盐酸。
(1)如图是某市售盐酸试剂瓶标签上的部分数据。则该盐酸的物质的量浓度是___ mol·L-1。
(2)某同学用该浓盐酸配制100mL 1mol·L-1的稀盐酸。请回答下列问题:
①通过计算可知,需要用量筒量取浓盐酸 ____ mL。
②使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______。
③若配制过程遇下列情况,溶液的物质的量浓度将会:(填“偏高”“偏低”“无影响”)
A.量取的浓盐酸置于烧杯中较长时间后配制______。
B.转移溶液前,洗净的容量瓶内壁附有水珠而未干燥处理___。
C.定容时俯视容量瓶的刻度线_____。
(Ⅱ)实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。已知:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
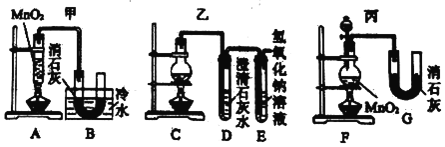
(1)哪位同学的装置能够有效地防止副反应的发生?_____。
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)_____。
(3)利用(2)中实验装置进行实验,实验中若用12 mol·L-1的浓盐酸200 mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3 mol,其可能的主要原因是_____(假定各步反应均无反应损耗且无副反应发生)。
(Ⅲ)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气一氯水体系,该体系中Cl2、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。
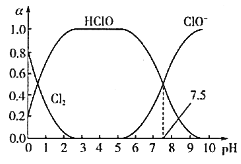
由图分析,欲使氯水的杀菌效果最好,应控制的pH范围是__,当pH=7.5时,氯水中含氯元素的微粒有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列五种元素的电离能数据(单位:kJ·mol-1),回答下列各题。

(1)在周期表中,最可能处于同一族的是________(填字母,下同)。
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)它们的氯化物的化学式,最可能正确的是________。
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(3)S元素最可能是________。
A.s区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(4)下列元素中,化学性质和物理性质最像Q元素的是________。
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1) D.氢(1s1) E.氦(1s2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列转化关系,回答有关问题:

已知CH3CHO在一定条件下可被氧化为CH3COOH。
(1)A的结构简式为________,C试剂是________,砖红色沉淀是________(填化学式)。
(2)B溶液的作用是__________。
(3)④和⑥反应的化学方程式及反应类型分别为:
④_______, _______________。
⑥________, _________。
(4)由图示转化关系可知淀粉________(填“部分水解”或“完全水解”)。某同学取图中混合液E,加入碘水,溶液不变蓝色,________(填“能”或“不能”)说明淀粉水解完全,原因是__________。若向淀粉中加入少量硫酸,并加热使之发生水解,为检验淀粉水解的情况所需的试剂是________。(填序号)
①NaOH溶液 ②新制Cu(OH)2悬浊液 ③BaCl2溶液 ④碘水
(5)在进行蔗糖的水解实验并检验水解产物中是否含有葡萄糖时,某同学的操作如下:取少量纯蔗糖加水配成溶液,在蔗糖溶液中加入3~5滴稀硫酸,将混合液煮沸几分钟、冷却,在冷却后的溶液中加入新制Cu(OH)2悬浊液,加热,未见砖红色沉淀。其原因是________(填字母)。
a.蔗糖尚未水解
b.蔗糖水解的产物中没有葡萄糖
c.加热时间不够
d.煮沸后的溶液中没有加碱液无法中和稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,lmolCH3OH与一定量O2发生反应时,生成CO、CO2或HCHO的能量变化如下图所示[反应物O2(g)和生成物H2O(g)已略去]。

回答下列问题:
(1)在有催化剂作用下,CH3 OH与O2反应主要生成 ___(填“CO2、CO或HCHO”);计算:2HCHO(g)+O2(g)=2CO(g)+2H2O(g)![]() =_____________
=_____________
(2)已知:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]()
①经测定不同温度下该反应的平衡常数如下:

该反应为 ___(填“放热”或“吸热”)反应;250℃时,某时刻测得该反应的反应物与生成物浓度为c(CO) =0.4mol/L、c(H2) =0. 4mol/L、c(CH3 OH) =0. 8mol/L,则此时υ(正)____υ(逆)(填“>”、“=”或“<”)。
②某温度下,在体积固定的2L密闭容器中将1molCO和2molH2混合,使反应得到平衡,实验测得平衡时与起始时的气体压强比值为0 .7,则该反应的平衡常数为____(保留l位小数)。
(3)利用钠碱循环法可除去SO2。常温下,若吸收液吸收一定量SO2后的溶液中,n(SO32-):n(HSO3-) =3:2,则此时溶液呈____(填“酸性”、“中性”或“碱性”)。(已知:H2SO3的电离常数为:Kal=l. 54×10-2、Ka2=l. 02×l0-7)
(4)利用电化学法处理工业尾气SO2的装置如图所示,写出Pt(2)电极反应式:______;当电路中转移0. 02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加___ mol离子。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(L.Pauling)教授的诞辰100周年。1994年这位老人谢世后,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它能合成吗?它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜,也许有朝一日你就能解开它。不管结果如何,让我们先对这个结构作一番了解。

(1)它的分子式是__________________________________________________________。
(2)它的所有原子是否可能处于同一个平面上?________(填“可能”或“不可能”)。
(3)它是否带有电荷?________(填“是”或“否”)。
(4)该分子中sp杂化的氮原子有___个;sp2杂化的氮原子有___个;sp3杂化的氮原子有_____个。
(5)为什么人们推测它是炸药?______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com