
瘦肉精在医学上称为“盐酸克伦特罗”.它是白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚,属β﹣兴奋剂类激素.是严重危害畜牧业健康发展和畜产品安全的毒品.其化学成分如图,下列有关盐酸克伦特罗说法错误的是()

A. 分子式为C12H1 8Cl2N2O
8Cl2N2O
B. 分子结构中有6个饱和碳原子
C. 分子中含氧官能团的名称是羟基
D. 能溶于所有有机溶剂
考点: 常见有机化合物的结构;烃的衍生物官能团.
专题: 有机物分子组成通式的应用规律.
分析: A.由结构简式可知分子式;
B.饱和碳原子是分子中处于四面体结构中心的碳原子;
C.分子中含氧官能团为羟基;
D.该化合物中含有羟基,不溶于有机溶剂乙醚;
解答: 解:A.由结构简式可知分子式为C12H18Cl2N2O,故A正确;
B.分子中处于四面体结构中心的碳原子有6个,所以有6个饱和碳原子,故B正确;
C.分子中含氧官能团的名称是羟基,故C正确;
D.该化合物中含有羟基,不溶于有机溶剂乙醚,故D错误;
故选D;
点评: 本题考查有机物的结构与性质,把握官能团与性质的关系为解答的关键,题目难度不大.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
铬是人体必需的微量元素,但铬过量会引起污染,危害人体健康。不同价态的铬毒性不一样,六价铬的毒性最大。下列叙述错误的是( )
A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶
B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬
C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性
D.1 mol 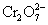 得到6 mol电子时,还原产物是Cr3+
得到6 mol电子时,还原产物是Cr3+
查看答案和解析>>
科目:高中化学 来源: 题型:
为了鉴定卤代烃中所含有的卤素原子, 现有下列实验操作步骤.正确的顺序是()
现有下列实验操作步骤.正确的顺序是()
①加入AgNO3 ②加入少许卤代烃试样 ③加热 ④加入5mL 4mol/L NaOH溶液 ⑤加入5mL 4mol/L HNO3溶液.
A. ②④③① B. ②④③⑤① C . ②⑤③①④ D. ②⑤①③④
. ②⑤③①④ D. ②⑤①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在研究的化合物分子中,所处环境完全相同的氢原子在质子核磁共振谱(PMR)中出现同一种信号峰,如(CH3)2CHCH2CH3在PMR谱中有四种信号峰.
化学式为C2H6O的物质在PMR谱上观察到下列两种情况下:化合物A出现一个信号峰,化合物B出现三个信号峰,由此可推断有机物质结构式为:
A 、B .
(2)①生活中PVC管材的成分为聚氯乙烯.氯乙烯可以由乙炔和氯化氢反应制得,其化学方程式为CH≡CH+HCl CH2=CHCl;②聚乙炔是制备有机导体材料的重要原料,请写出制得聚乙炔的化学方程式 ;.
CH2=CHCl;②聚乙炔是制备有机导体材料的重要原料,请写出制得聚乙炔的化学方程式 ;.
(3)C7H8是苯的同系物,①它的一氯代物有4种;②它被酸性高锰酸钾溶液氧化后,有机产物的结构简式为 ;③它可以与足量的浓硫酸和浓硝酸的混酸反应制备烈性炸药TNT,反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列实验事实所得出的结论,正确的是()
实验事实 结论
① Cl2的水溶液可以导电 Cl2是电解质
② 常温下,0.1mol•L﹣1NaA与NaB溶液的pH前者大 酸性:HA<HB
③ 常温下,白磷可自燃而硫不与氧气反应 非金属性:P>S
④ 某溶液中滴加KSCN溶液,溶液变为血红色 该溶液含有Fe3+
A. ③④ B. ②④ C. ①② D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
I、磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成 白磷,反应为:
白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| 0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
该实验的目的是_____________________;表中V2=___________mL
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O === □Ce(OH)4↓+□_______
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com