
分析 (1)根据反应速率v=$\frac{△c}{△t}$进行计算达到化学平衡状态时以NH3表示的化学反应速率;
(2)根据化学反应速率与化学计量数成正比计算出用O2、NO表示的化学反应速率;
(3)根据n=vt计算出达到平衡状态时生成NO的物质的量.
解答 解:(1)NH3的起始浓度为8mol/L,5min后达到化学平衡状态,NH3浓度为2mol/L,则达到化学平衡状态时以NH3表示的化学反应速率为:v=$\frac{8mol/L-2mol/L}{5min}$=1.2mol/(L•min),
答:达到化学平衡状态时以NH3表示的化学反应速率为1.2mol/(L•min);
(2)根据反应方程式4NH3(g)+5O2(g)═4NO(g)+6H2O(g)可知,v(O2)=$\frac{5}{4}$v(NH3)=1.2mol/(L•min)×$\frac{5}{4}$=1.5mol/(L•min);
v(NO)=v(NH3)=1.2mol/(L•min),
答:用O2、NO 表示的化学反应速率分别为1.5mol/(L•min)、1.2mol/(L•min);
(3)v(NO)=v(NH3)=1.2mol/(L•min),则达到平衡时生成NO的物质的量为:n(NO)=1.2mol/(L•min)×5min=6mol,
答:达到化学平衡状态时NO的物质的量是6mol.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率与化学计量数的关系为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 气体摩尔体积为22.4L/mol | B. | 1molNaOH的质量为40g | ||
| C. | 0.5molCO2的体积为11.2L | D. | H2O的摩尔质量为18g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
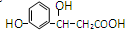 ,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )
,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )| A. | ①⑤⑧ | B. | ①②⑤⑨ | C. | ②⑥⑧⑨ | D. | ②⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )| A. | 奎尼酸的分子式是C7H9O6 | |
| B. | 1mol奎尼酸与足量NaOH溶液反应,最多消耗NaOH物质的量为5mol | |
| C. | 1 mol奎尼酸与足量钠反应生成56L氢气 | |
| D. | 奎尼酸能发生消去反应,也能与乙醇、乙酸发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com