
 为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下:
为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下:| 编号 | V(CH3COOH)/mL | V(NaOH)/mL | |
| 初读数 | 末读数 | ||
| 1 | 25.00 | 0.00 | 25.00 |
| 2 | 25.00 | 1.00 | 26.02 |
| 3 | 25.00 | 1.10 | 26.08 |
| b |
| 2 |
| b |
| 2 |
| c(标注)×V(标准) |
| V(待测) |
| b |
| 2 |
| 10-3 |
| 0.05000 |
| 10-3×10-3 |
| 0.05000 |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 (其中R、R1、R2、R3和R4均表示烃基)今有A~K等11种不同的有机物,它们之间的转化关系如下.其中A为烃,1mol A可得2mol B.
(其中R、R1、R2、R3和R4均表示烃基)今有A~K等11种不同的有机物,它们之间的转化关系如下.其中A为烃,1mol A可得2mol B.
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1的干燥烧瓶中盛有CO2,烧杯和滴管内盛有饱和NaHCO3溶液,挤压胶管的胶头会形成无色喷泉 |
| B、图2中若X为碳棒,开关K置于N处,铁极的反应:Fe-2e-═Fe2+ |
| C、图3中装置(Ⅰ)为一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红,则电极B发生了还原反应 |
| D、用图4验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色透明的溶液:Fe3+、K+、OH-、NO3- |
| B、与Al反应生成H2的溶液:Na+、Ma2+、NO3-、HCO3- |
| C、c(OH-)=1mol/L的溶液:K+、Ca2+、Cl-、H2SO3 |
| D、CH3COOH:SO42-、Cl-、Cu2+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液跟稀盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| B、碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| D、氯化铁溶液中加入过量的铁粉:Fe3++Fe=Fe 2+ |
| E、向稀氨水中加入稀盐酸:NH3?H2O+H+=NH4++H2O |
| F、小苏打溶液个烧碱溶液反应:HCO3-+OH-=CO32-+H2O |
| G、氢氧化钡溶液与稀硫酸反应:Ba2++OH-+H++SO42-═H2O+BaSO4↓ |
| H、铁和稀硫酸反应:2Fe+3H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
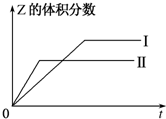 (1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:
(1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后再停止加热 |
| B、蒸馏时,温度计水银球需靠近蒸馏烧瓶支管口,冷凝水的流向需从冷凝管的上口进下口流出 |
| C、过滤后洗涤沉淀时,应将固体转移至烧杯中,并加入适量蒸馏水充分搅拌后再过滤 |
| D、分液时,先从分液漏斗下口放出下层液体,更换烧杯后再从上口放出上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上层橙红色,下层接近无色 |
| B、均匀、透明、紫红色 |
| C、均匀、透明、无色 |
| D、上层接近无色,下层紫红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com