

分析 (1)根据仪器的结构特点判断;
(2)根据温度与醋酸的收率最高判断最佳反应温度,根据加热的要求选择加热的方法;
(3)A、在实验过程中,通过快速冷却草酸溶液,得不到较大的晶体颗粒,应该是自然冷却;
B、在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失;
C、由于装置中存在压强差,所以为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验;
D、在坩埚中直接加热,容易使草酸晶体分解;
(4)①根据草酸溶液的酸碱性及量取溶液的精确度选用相应的仪器;
②A、根据润洗滴定管的基本操作要求判断;
B、移液管取草酸溶液时,不能将尖嘴处的液体吹入锥形瓶,否则使实验误差偏高;
C、根据滴定管规范操作要求判断;
D、根据滴定中的误差分析方法进行判断;
③由于酸性高锰酸钾溶液显紫红色,所以滴定终点的判断依据是向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色;
④反应中消耗高锰酸钾的物质的量是0.02L×0.1000mol/L=0.002000mol,所以根据方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,消耗草酸的物质的量是0.005000mol.
解答 解:(1)根据装置的结构特点可知,A应该是三颈烧瓶,
故答案为:三颈烧瓶;
(2)根据图3可知,在温度为70℃时,醋酸的收率最高,所以选择的最佳反应温度是70℃.由于温度不超过100℃,所以采用水浴加热,这是由于水浴加热时便于控制温度,且能使装置受热均匀;
故答案为:70℃;便于控制温度,使装置受热均匀;
(3)A、在实验过程中,通过快速冷却草酸溶液,得不到较大的晶体颗粒,应该是自然冷却,A不正确;
B、在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失,B正确;
C、由于装置中存在压强差,所以为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验,C正确;
D、在坩埚中直接加热,容易使草酸晶体分解,D不正确;
故答案为BC;
(4)①草酸溶液显酸性,所以量取25.00mL草酸溶液的仪器是酸式滴定管,
故答案为:酸式滴定管;
②A、润洗滴定管时,应从滴定管上口加少量所需的酸或碱液,使滴定管内壁充分润洗,并不需要加满,故A不正确;
B、移液管取草酸溶液时,不能将尖嘴处的液体吹入锥形瓶,否则使实验误差偏高,故B不正确;
C、滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液,故C正确;
D、滴定终点读取滴定管刻度时,仰视标准液液面,由于读数自上而下逐渐增大,所以读数偏大,会使实验误差偏高,故D正确;
故答案为:CD;
③由于酸性高锰酸钾溶液显紫红色,所以滴定终点的判断依据是向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色;
故答案为:向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色;
④反应中消耗高锰酸钾的物质的量是0.02L×0.1000mol/L=0.002000mol,所以根据方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,消耗草酸的物质的量是0.005000mol,因此原样品中草酸的物质的量是0.005000mol×$\frac{250ml}{25ml}$=0.05000mol/L,则质量=0.05000mol/L×126g/mol=6.3g,所以草酸的纯度是$\frac{6.3g}{7.2g}$×100%=87.5%.
故答案为:87.5%.
点评 本题考查了物质组成的实验探究方法和实验过程判断,滴定实验注意问题和充分的计算应用,掌握基础是解题关键,题目难度中等.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.18g | B. | 2.12g | C. | 4.22g | D. | 5.28g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
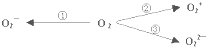 据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取7.6g硫酸铜,加入500 mL的水 | B. | 称取8.0g硫酸铜,配成500mL溶液 | ||
| C. | 称取12.0g胆矾,配成500mL溶液 | D. | 称取12.5g胆矾,加入500mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫是氧化剂,KOH是还原剂 | |
| B. | 反应中共转移4摩尔电子 | |
| C. | 还原剂和氧化剂质量比是1:2 | |
| D. | 氧化产物和还原产物的质量比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前科学家已制得单原子层锗,其电子迁移率是硅的10倍,有望用于制造高能计算机芯片 | |
| B. | 2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代,利用此类光显微镜可以观察活细胞内蛋白质等大分子 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com