
��Na2CO3��NaAlO2�Ļ����Һ����μ���150mL 1mol•L-1��HCl��Һ�������Һ�е�ij�����������ʵ����ı仯��ͼ��ʾ��������˵������ȷ���ǣ� ��
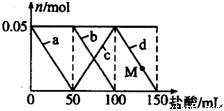
A��a���߱�ʾ�����ӷ���ʽΪ��AlO2-+H++H2O=Al��OH��3
B��b��c���߱�ʾ�����ӷ�Ӧ����ͬ��
C��M��ʱAl��OH��3������С��3.9g
D��ԭ�����Һ�е�CO32-��AlO2-�����ʵ���֮��Ϊ2��1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�������¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
���ô������ɽ�����β���е�NO��COת���CO2��N2����ѧ����ʽ���£�2NO+2CO 2CO2+N2��ij�¶��£����ݻ�������ܱ�������ͨ��NO��CO����ò�ͬʱ���NO��CO��Ũ�����±���
2CO2+N2��ij�¶��£����ݻ�������ܱ�������ͨ��NO��CO����ò�ͬʱ���NO��CO��Ũ�����±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c��NO��/��10-3mol��L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c��CO��/��10-3mol��L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |


 ����˵���У�����ȷ����
����˵���У�����ȷ����
 A��2s�ڵ�ƽ����Ӧ���ʦԣ�N2����1.875��10-4mol��L-1��s-1
A��2s�ڵ�ƽ����Ӧ���ʦԣ�N2����1.875��10-4mol��L-1��s-1
 B���ڸ��¶��£���Ӧ��ƽ�ⳣ��K��5
B���ڸ��¶��£���Ӧ��ƽ�ⳣ��K��5
 C�������ݻ���СΪԭ����һ�룬NOת���ʴ���90%
C�������ݻ���СΪԭ����һ�룬NOת���ʴ���90%
 D��ʹ�ô���������ߵ�λʱ��CO��NO�Ĵ�����
D��ʹ�ô���������ߵ�λʱ��CO��NO�Ĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ĸ��������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A���ϳɰ���Ӧ��Ϊ���������Ӧ���ʣ���ʱ���߰���
B��SO2��������ͨ��������������SO2��ƽ��ת����
C���ϳɰ��м����������ߵ�����ƽ��ת����
D���ϳɰ���Ӧ����С�����������ʹƽ�������ƶ������Ե���Ũ�ȼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ���������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ͨ�����·�Ӧ���ɻ�ȡH2�������й�˵����ȷ�� �ǣ� ��
�ǣ� ��
��̫������ֽ�ˮ���⣺2H2O��l����2H2��g��+O2��g����H1=+571.6kJ��mol�C1
�ڽ�̿��ˮ��Ӧ���⣺C��s��+H2O��g����CO��g��+H2��g����H2=+131.3kJ��mol�C1
�ۼ�����ˮ��Ӧ���⣺CH4��g��+H2O��g����CO��g��+3H2��g����H3=+206.1kJ��mol�C1
A����Ӧ���е���ת��Ϊ��ѧ��
B����Ӧ��Ϊ���ȷ�Ӧ
C����Ӧ��ʹ�ô�������H3��С
D����ӦCH4��g���� C��s��+2 H2��g���Ħ�H4=+74.8kJ ��mol�C1
��mol�C1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ���������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʷ���������ȷ��һ���ǣ� ��
������������:SO2��NO��CO2��SiO2
�ڵ����ʡ����ᡢˮ��������ˮ��Ϊ�����
��������С�մ����ᱵ��HClO��Ϊ�����
�ܵ�ơ�ţ�̡�������Ư�۾���Ϊ����
��Һ����Һ�ȡ��ɱ����⻯����Ϊ������
A���ٺ͢� B���ۺ͢� C���ں͢� D���ں͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�������¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
����úȼ�ջ����������Ⱦ��Ϊ���θ���Ⱦ��ij����������µ����۷�����ͬʱ�ɵõ�������Ʒ���ù���������ͼ��ʾ��������������ȷ����
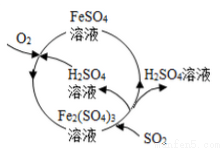
A���ù����пɵõ�������ƷH2SO4
B���ù��������dz�ȥúȼ��ʱ������SO2
C���ù����л��ϼ۷����ı��Ԫ��ΪFe��S
D��ͼ���漰���ķ�Ӧ֮һΪFe2��SO4��3+SO2+2H2O==2FeSO4+2H2SO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�������¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
�谢��٤����������ֵ������˵����ȷ����
A����1molFeCl3��Һˮ������1molFe��OH��3���������NA����������
B��������ΪNA��N2��CO����������Ϊ22.4L������Ϊ28g
C��0.5molFeBr2������������Ӧת�Ƶĵ�����ΪNA
D������Zn��һ������Ũ���ᷴӦ������22.4L��״������ʱ��ת�Ƶĵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�������ĵ��������ѧ���������л�ѧ���������棩 ���ͣ�ѡ����
�����йط�Ӧ�ȵ�˵����ȷ����
A�����ȷ�Ӧһ����Ҫ���ȣ����ȷ�Ӧһ������Ҫ����
B�������ȼ���ȡ�H=��890kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽΪ��
CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=��890kJ/mol
C�����³�ѹ�£�HCl��aq��+NaOH��aq��=NaCl��aq��+H2O��l����H=��57.3 kJ/mol
����H2SO4��aq��+ Ba��OH��2��aq��=BaSO4��s��+2H2O��l����H=��114.6 kJ/mol
D��S��s��+O2��g��=SO2��g����H1=��Q1kJ/mol
S��g�� +O2��g��=SO2��g����H2=��Q2kJ/mol����Q1��Q2
+O2��g��=SO2��g����H2=��Q2kJ/mol����Q1��Q2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ������ѧ��11���¿���ѧ�Ծ��������棩 ���ͣ������
�⼰�仯����������������ͿƼ��ȷ��涼������Ҫ��Ӧ�á��ش��������⣺
��1���ⲻ������ˮ���������ڵ⻯����Һ�����ɶ�����ӣ���Ӧ���£�
��I2��s��+I-��aq�� I3-��aq����H<0����I2��s��+2I-��aq��
I3-��aq����H<0����I2��s��+2I-��aq�� I42-��aq��
I42-��aq��
��Ӧ�ڵ�ƽ�ⳣ���ı���ʽΪK=____________���¶�����ʱ����Ӧ�ٵ�ƽ�ⳣ����____________���������С�����䡱��
��2����������һ���¶��£��ɷ������¿��淴Ӧ��W��s��+I2��g�� WI2��g����ȷ��ȡ0.508g���0.736g�����ٷ�����50.0mL���ܱ������У�������ʹ�䷴Ӧ����ͼ�ǻ�������е�WI2���������ʵ�����ʱ��仯��ϵ��ͼ��[n��WI2����t]���������ߢ�0��t2ʱ��Σ��ķ�Ӧ�¶�Ϊ450�棬���ߢ�t2ʱ�̿�ʼ���ķ�Ӧ�¶�Ϊ530��
WI2��g����ȷ��ȡ0.508g���0.736g�����ٷ�����50.0mL���ܱ������У�������ʹ�䷴Ӧ����ͼ�ǻ�������е�WI2���������ʵ�����ʱ��仯��ϵ��ͼ��[n��WI2����t]���������ߢ�0��t2ʱ��Σ��ķ�Ӧ�¶�Ϊ450�棬���ߢ�t2ʱ�̿�ʼ���ķ�Ӧ�¶�Ϊ530��
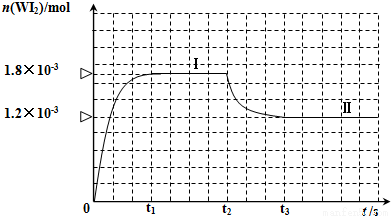
�ٸ÷�Ӧ��H_________0���>����<������
�ڷ�Ӧ�ӿ�ʼ��t1��t1=3min��ʱ���ڵ�ƽ������v��I2��= ____________
����450��ʱ���÷�Ӧ��ƽ�ⳣ��K=____________��
���ܹ�˵��������Ӧ�Ѿ��ﵽƽ��״̬����____________ ����ѡ����ĸ��
A.I2��WI2��Ũ�����
B.��λʱ���ڣ����������ĵ����ʵ����뵥�ʵ����ɵ����ʵ������
C.�����ڻ��������ܶȲ��ٸı�
D.����������ѹǿ�������仯
��3��I2O5�ǰ�ɫ��ĩ״���壬������������ʹH2S��CO��HC1���������ںϳ� ����ҵ�г���I2O5����������CO�ĺ�����
����ҵ�г���I2O5����������CO�ĺ�����
��֪����2I2��s��+5O2��g����2I2O5��s����H��-75.56kJ•mol-1
�� 2CO��g��+O2��g����2CO2��g����H��-566.0kJ•mol-1��
2CO��g��+O2��g����2CO2��g����H��-566.0kJ•mol-1��
д��CO��g����I2O5��s����Ӧ������̬I2���Ȼ�ѧ����ʽ��_____________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com