
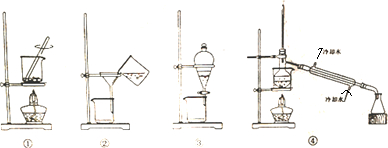
| A. | 装置①将海带灼烧成灰 | B. | 装置②过滤含I-的溶液 | ||
| C. | 装置③放出碘的CCl4溶液 | D. | 装置④分离碘并回收CCl4 |
分析 A.灼烧固体,应在坩埚中进行;
B.过滤时应用玻璃棒引流;
C.碘易溶于四氯化碳;
D.回收萃取剂苯并获得单质碘,可用蒸馏的方法,注意温度计的位置以及水的进出方向.
解答 解:A.灼烧固体温度较高,应在坩埚中进行,故A错误;
B.过滤时应用玻璃棒引流,故B错误;
C.碘易溶于四氯化碳,不能用分液的方法分离,应用蒸馏的方法,故C错误;
D.回收萃取剂苯并获得单质碘,可用蒸馏的方法,温度计位于蒸馏烧瓶的支管口,且水从下端进,上端出,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯及实验基本操作等为解答的关键,侧重提纯碘的实验及分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学能和电能的相互转化是能量转化的重要形式,电池在现代生活的很多方面得到广泛应用.
化学能和电能的相互转化是能量转化的重要形式,电池在现代生活的很多方面得到广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | |
| ②工业炼铁时,把铁矿石预先粉碎后,再进行炼制 | |
| ③用H2O2分解制O2,加入MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 ( g )+$\frac{3}{2}$O2( g )═2H2O ( l )+CO ( g )△H1 | |
| B. | S ( s )+$\frac{3}{2}$O2 ( g )═SO3 ( s )△H2 | |
| C. | C6H12O6 ( s )+6O2 ( g )═6CO2 (g)+6H2O ( l )△H3 | |
| D. | 2CO ( g )+O2( g )═2CO2 ( g )△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Zn为负极,Cu为正极 | B. | 正极反应式为:Zn-2e-═Zn2+ | ||
| C. | 负极反应式为:Cu-2e-═Cu2+ | D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 环氧乙烷是甲醛的同系物 | |
| B. | 环氧乙烷是乙醛的同分异构体,肯定能发生银镜反应 | |
| C. | 等质量的环氧乙烷与乙酸乙酯分别完全燃烧时耗氧量相同 | |
| D. | 环氧乙烷性质非常稳定,不易燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com