
【题目】M、Q、R、X、Y为原子序数依次增大的短周期主族元素。M原子核外电子有6种运动状态,R和X同主族。Z、W是第四周期过渡元素,Z2+的外围电子数是W+的外围电子数的一半,W+没有未成对电子。请回答下列问题:
(1)W+的外围电子排布图为__________。
(2)M、Q和R第一电离能由小到大的顺序是________(用元素符号表示)。
(3)Q的气态氢化物极易溶于R的常见氢化物,其原因有__________________。该浓液显碱性,请用结构表示出两者的主要结合方式_________。
(4)在上述元素形成的微粒中,和MR2互为等电子体的有________(分子和离子各写一种),Q与Y形成的QY3分子的空间构型是__________。
(5)MR2晶体和W晶体的晶胞如图表示(●表示一个MR2分子或一个W原子)。
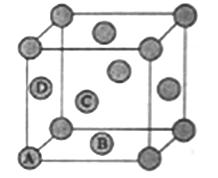
①在MR2晶体中,最近的分子间距为a㎝,则晶体密度为____g/㎝3(阿伏加德罗常数的值用NA表示,不必计算结果)。
②W晶体中A、B、C、D围成正四面体空隙,该晶胞中正四面体空隙的数目为_____。某种Z的硫化物晶体中S2-以W晶体中W原子的方式堆积,Z2+填充在正四面体空隙中,则Z2+的填充率(填充Z2+的正四面体空隙数和正四面体空隙总数之比)为_______。
【答案】 3d![]() C<O<N NH3与H2O分子间可形成氢键;NH3为极性分子,根据相似相溶原理易溶于极性溶剂水中;NH3与水反应,产物易溶于水
C<O<N NH3与H2O分子间可形成氢键;NH3为极性分子,根据相似相溶原理易溶于极性溶剂水中;NH3与水反应,产物易溶于水 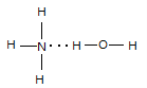 N2O,SCN- 三角锥形
N2O,SCN- 三角锥形 ![]() 8 50%
8 50%
【解析】M原子核外电子有6种运动状态,说明X核外有6个电子,即M为C,W+没有未成对电子,W属于第四周期的过渡元素,因此W为Cu,Z2+的外围电子数是Cu+的外围电子数的一半,即Z的外围电子排布式为3d54s2,即Z为Mn,R和X为同主族,X和Y为第三周期,Q与R为第二周期,因此Q为N、R为O、X为S、Y为Cl,(1)考查电子排布图和外围电子的含义,外围电子对过渡元素来说,指的是最外层电子和次外层上的d能级,因此Cu+的外围电子排布图是3d![]() ;(2)考查第一电离能的规律,同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此第一电离能的大小顺序是C<O<N;(3)考查氢化物的溶解性,Q的氢化物是NH3,R的氢化物是H2O,NH3易溶于水,是因为NH3与水形成分子间氢键,NH3是极性分子,H2O也是极性分子,利用“相似相溶”的原理; NH3中的N与H2O中的H形成分子间氢键,以电离出OH-,其结构是
;(2)考查第一电离能的规律,同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此第一电离能的大小顺序是C<O<N;(3)考查氢化物的溶解性,Q的氢化物是NH3,R的氢化物是H2O,NH3易溶于水,是因为NH3与水形成分子间氢键,NH3是极性分子,H2O也是极性分子,利用“相似相溶”的原理; NH3中的N与H2O中的H形成分子间氢键,以电离出OH-,其结构是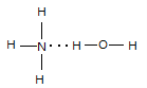 ;(4)考查等电子体的判断,与CO2互为等电子体的是N2O、SCN-等;构成的化学式NCl3,中心原子N有3个σ键,孤电子对数为(5-3)/2=1,杂化类型为sp3,空间构型为三角锥形;(5)考查晶胞的计算,①根据晶胞的结构,CO2最近的距离是面对角线的1/2,即晶胞的边长为
;(4)考查等电子体的判断,与CO2互为等电子体的是N2O、SCN-等;构成的化学式NCl3,中心原子N有3个σ键,孤电子对数为(5-3)/2=1,杂化类型为sp3,空间构型为三角锥形;(5)考查晶胞的计算,①根据晶胞的结构,CO2最近的距离是面对角线的1/2,即晶胞的边长为![]() acm,晶胞的体积为(
acm,晶胞的体积为(![]() a)3cm3,根据晶胞结构,一个晶胞中含有CO2的个数为8×1/8+6×1/2=4,则晶胞的质量为4×44/NAg,根据密度的定义,密度为4×44/[NA×(
a)3cm3,根据晶胞结构,一个晶胞中含有CO2的个数为8×1/8+6×1/2=4,则晶胞的质量为4×44/NAg,根据密度的定义,密度为4×44/[NA×(![]() a)3]g/cm3=
a)3]g/cm3=![]() g/cm3;②根据晶胞的结构,一个顶点形成一个正四面体形,共有8个顶点,形成8个正四面体形;S2-的化合价-2价,Mn的化合价为+2价,则化学式为MnS,S2-占据Cu的位置,晶胞中S2-的个数为4,则Mn2+的个数为4,即填充到4个正四面体形中,晶胞中共有8个正四面体形,即填充率为4/8×100%=50%。
g/cm3;②根据晶胞的结构,一个顶点形成一个正四面体形,共有8个顶点,形成8个正四面体形;S2-的化合价-2价,Mn的化合价为+2价,则化学式为MnS,S2-占据Cu的位置,晶胞中S2-的个数为4,则Mn2+的个数为4,即填充到4个正四面体形中,晶胞中共有8个正四面体形,即填充率为4/8×100%=50%。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列物质所含分子数最少的是( )
A. 含NA个氢分子的氢气 B. 标准状况下22.4L氨气
C. 8g甲烷(甲烷的摩尔质量为16g·mol-1) D. 0.8mol二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI+5KIO3+3H2S=3I2+3K2SO4+3H2O,下列说法正确的是( )
A.3 mol H2S可还原4mol的KIO3
B.氧化剂和还原剂物质的量之比为5:4
C.I2是还原产物,K2SO4是氧化产物
D.1molKIO3可氧化0.2mol的KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)═ 4NO(g)+6H2O(l)△H═﹣xkJ/mol.蒸发1mol H2O(l)需要吸收的能量为44kJ,其它相关数据如下表:则表中z(用x、a、b、d表示)的大小为( )
物质 | NH3(g) | O2(g) | NO(g) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | a | b | z | d |
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 离子化合物中只能含离子键,不能有共价键
B. 熔融状态下能导电的物质一定是离子化合物
C. 电子数相同的两种微粒一定是同一元素
D. 完全由非金属元素形成的化合物中可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向不同电解质溶液中加入新物质时,其电流强度(I)随新物质加入量(m)的变化曲线不正确的是( )
A.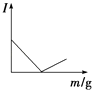 向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量
向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量
B.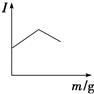 向醋酸溶液中逐滴加入等浓度的氨水至过量
向醋酸溶液中逐滴加入等浓度的氨水至过量
C.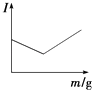 向盐酸溶液中逐滴加入等浓度的NaOH溶液至过量
向盐酸溶液中逐滴加入等浓度的NaOH溶液至过量
D.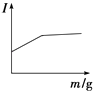 向氨水中逐滴加入等浓度的盐酸至过量
向氨水中逐滴加入等浓度的盐酸至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验用酸性KMnO4溶液不能达到预期目的的是
A.鉴别SO2和CO2B.检验CH2=C(CH3)CHO中含碳碳双键
C.鉴别苯和甲苯D.检验硫酸铝溶液中是否有硫酸亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素A的外围电子排布式为ns1,另一主族元素B的外围电子排布为ns2np4,两者形成的离子化合物的化学式可能为( )
A. AB B. A2B
C. AB2 D. A2B3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com