
【题目】氯化亚铜是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
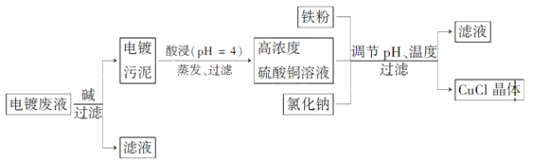
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
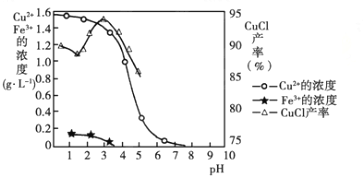
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
(6)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应:___________。
【答案】 Cu(OH)2+2H+=Cu2++2H2O 3 2Cu2++2Cl-+Fe=2CuCl↓+Fe2+ 加快乙醇和水的蒸发,防止CuCl被空气氧化 Na2SO4和FeSO4 不同温度下硫酸钠和硫酸亚铁的溶解度 2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4 OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率。但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率 Cu2++Cl-+e-=CuCl↓
【解析】(1)电镀废液加碱处理时生成的电镀污泥中主要成分为Cu(OH)2和Fe(OH)3,在pH=4的条件下进行酸浸,又知Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7,所以酸浸时Fe(OH)3不会溶解,而Cu(OH)2则完全溶解,所以反应的离子方程式为Cu(OH)2+2H+=Cu2++2H2O;根据图象可知CuCl晶体析出产率最高时对应的pH在3左右。
(2)由转化关系可知,反应物为铁粉、氯化钠、硫酸铜,生成物为CuCl,还有硫酸亚铁和硫酸钠,所以反应的离子方程式为2Cu2++2Cl-+Fe= 2CuCl↓+Fe2+ 。
(3)因为氯化亚铜在空气中会被迅速氧化成绿色碱式盐,所以要隔绝空气进行真空干燥、密封包装,在70℃下进行干燥,能够加快乙醇和水分的蒸发。
(4)由(2)的分析可知,滤液的主要的成分为Na2SO4和FeSO4,要想从中分离出FeSO4,并析出FeSO4·7H2O晶体,一定要知道硫酸钠和硫酸亚铁在不同温度下的溶解度,才能采取措施进行分离、结晶。
(5)若将铁粉换成亚硫酸钠,则反应方程式为2CuSO4+Na2SO3+2NaCl+H2O= 2CuCl↓ +2Na2SO4+H2SO4;根据反应方程式可知,在该反应体系中加入稀碱溶液,中和了反应生成的H2SO4,有利于平衡正向移动,提高CuCl的产率;同时调节pH为3.5,是为了防止OH-浓度过大,Cu+与OH-结合生成氢氧化亚铜,降低CuCl的产率。
(6)工业上还可采用以碳棒为电极,电解CuCl2溶液得到CuCl,在阴极附近Cu2+比H+更容易得到电子,所以阴极上的反应为 Cu2++ Cl- + e- =CuCl↓。


科目:高中化学 来源: 题型:
【题目】某工业废液里含有FeCl2、CuCl2和FeCl3 . 为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程: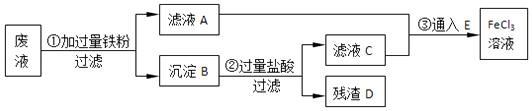
(1)A的化学式为 , E的化学式为 .
(2)B的化学成份 , 回收的铜是(填A、B、C、D或E).
(3)根据图示,反应②的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“一”相连的两种物质能发生反应)。下列判断正确的是

A. X是元素周期表中非金属性最强的元素
B. Z冶炼可通过电解其氯化物的方式获得
C. 4种原子中,Y离子半径最小
D. W的阴离子可能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膜技术原理在化工生产中有着广泛的应用,有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。下列说法不正确的是
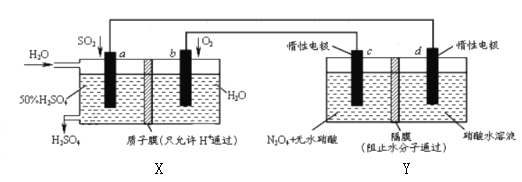
A. X是原电池,能够生产硫酸;Y是电解池,能够生产N2O5
B. C电极的电极反应方程式为N2O4+2HNO3-2e-=2N2O5+2H+
C. 当电路中通过2mole,X、Y中各有2molH+从左边迁移到右边
D. 电路中电子流向为a![]() d
d![]() c
c![]() b
b![]() a形成闭合回路
a形成闭合回路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+ S ![]() Na2S2O3,
Na2S2O3,
常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。

Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
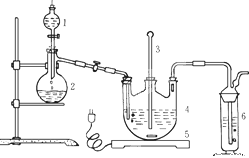
请问:(1)仪器2的名称为________,装置6中可放入_________。
A.BaCl2溶液 B.浓H2SO4
C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热。随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出。持续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7理由是________(用离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:

(1)为减少产品的损失,操作①为______,操作②是_____、洗涤、干燥,其中洗涤操作是用_________(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_______。
(3)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:![]() 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为_____________________。三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为_________ mol/L。
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为_____________________。三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为_________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于脂质的叙述中错误的是 ( )
A.脂肪是重要的储能物质,同质量的脂肪中含有比糖类更多的能量
B.脂质中的磷脂是构成细胞膜的主要成分之一
C.有的脂质可以由内分泌腺分泌,如性激素
D.胆固醇对生命活动具有一定的调节作用,所以它既是脂质也是激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B.2H2(g)+O2(g)=2H2O(l);△H=﹣571.6kJmol﹣1 , 则氢气燃烧热为285.8kJmol﹣1
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=﹣57.3kJmol﹣1
D.已知2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应CH4+2O2![]() CO2+2H2O的说法中,正确的是
CO2+2H2O的说法中,正确的是
A. 该反应中,热能转化为化学能
B. 反应物的总能量低于生成物的总能量
C. 反应时,断键吸收的总能量高于成键放出的总能量
D. 根据此反应设计的燃料电池,可提高甲烷的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com