
【题目】下列关于化学反应的说法中正确的是
A. 同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D. 相同温度下,H2(g)+CO2(g)![]() CO(g)+H2O(g)中,密闭容器中两种反应物浓度为0.020 mol·L-1的反应速率大于两种反应物浓度为0.010 mol·L-1的反应速率
CO(g)+H2O(g)中,密闭容器中两种反应物浓度为0.020 mol·L-1的反应速率大于两种反应物浓度为0.010 mol·L-1的反应速率
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在一个体积可变的密闭容器中充入2 mol的气体A和1 mol的气体B发生反应:2A(g)+B(g)![]() 3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )
3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )

A. 加入1 mol氦气
B. 加入1 mol B
C. 增大压强
D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.常温常压下,1.8g甲基(—CD3)中含有的电子数为NA
B.0. lmol环氧乙烷(![]() )中含有的共价键数为0. 3 NA
)中含有的共价键数为0. 3 NA
C.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为4.0 L的恒容密闭容器中,反应 CO2(g)+C(s)![]() 2CO(g) ΔH > 0,分别在一定温度下达到化学平衡状态。下列说法正确的是
2CO(g) ΔH > 0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.56 | 1.12 | 0 | 0.8 |
II | 977 | 1.12 | 1.12 | 0 | x |
III | 1250 | 0 | 0 | 1.12 | y |
A.977 K,该反应的化学平衡常数值为4
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器I中CO2的转化率比容器II中的大
D.达到平衡时,容器III中的CO的转化率大于28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
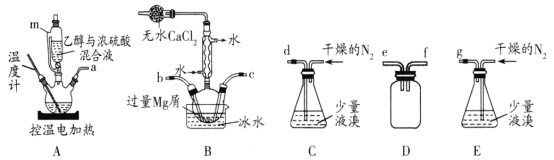
已知:①乙醚的熔点为-116.3℃,沸点为34.6℃。
②Mg和Br2反应非常剧烈,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
③不考虑氮气与镁的反应
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,使溴分子缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤,将滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
请回答下列问题:
(1)装置A中使用仪器m的优点是____。
(2)步骤I中所选装置的正确连接顺序是a ___ (填小写字母),装置D的作用是___。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是____。
(4)实验中不能用干燥空气代替干燥N2,原因是_______;
(5)有关步骤V的说法,正确的是_______;
A 可用95%的乙醇代替苯溶解粗品 B 洗涤晶体可选用0℃的苯
C 加热至160℃的主要目的是除去苯 D 该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度(假定杂质不参与反应),可用EDTA (简写为Y4-,无色)标准溶液滴定,以络黑T为指示剂(pH=6.3~11.6时显蓝色,pH>11.6时显橙色)。已知: Mg2+与络黑T形成的配合物(Mg2+-络黑T)呈酒红色,Mg2+与Y4-形成的MgY2-为无色;在pH约为9的缓冲溶液中滴定,反应的离子方程式为:Mg2+ + Y4-=MgY2-, Mg2+-络黑T+Y4- =MgY2- +络黑T。
①判断滴定终点的现象为_______.
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加人2滴络黑T试液作指示剂,用0. 0500 mol·L-1 EDTA标准溶液滴定至终点,消耗EDTA标准溶液25. 00 mL,则测得无水MgBr2产品的纯度是_________(以质量分数表示)。
(7)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证 CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到待测样品,_____________________。(补全实验操作)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-SO2充电电池具有高输出功率的优点。多孔碳电极可吸附SO2,电解液为溶解有LiBr的碳酸丙烯酯-乙腈溶液。下列说法错误的是( )
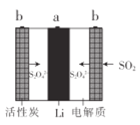
A.活性炭具有加快放电速率的作用
B.放电时,电子流向:a→溶液→b→a
C.充电时,阳极上发生的电极反应为:S2O42--2e-=2SO2
D.该电池的电解质溶液不能换成LiBr的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E五种物质都含有同一种元素,它们之间的转化关系如图所示,其中A为淡黄色固体化合物,B为单质。请回答下列问题。

(1)固体A的名称为_______________,其常见用途:_______________________________________。(仅举一例即可)
(2)写出下列反应的化学方程式:
①A→C_____________________________________________________________;
②A→D_____________________________________________________________;
③B→A_____________________________________________________________;
④B→C_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol14C中含有的中子数为0.8NA
B.4.6gC2H5OH中含有的共价键数目为0.7NA
C.24gO3与11.2LO2所含的分子数均为0.5NA
D.常温下pH=3的醋酸溶液中,OH-数目为10-11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用铁盐溶液溶解黄铁矿(主要成分为FeS2),发生如下过程。下列说法错误的是
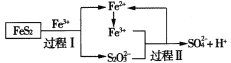
A.过程I每溶解120 g FeS2,理论上消耗6 mol Fe3+
B.过程Ⅱ每生成1 mol SO42-转移8 mol e-
C.总反应为FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
D.反应过程中鼓入大量的空气有利于反应的进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com