
 .
. ,所含化学键类型为离子键、共价键.
,所含化学键类型为离子键、共价键.分析 A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素;D元素是地壳中含量最多的元素,则D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E元素是短周期元素中金属性最强的元素,则E为Na;F与G的位置相邻,G是同周期元素中原子半径最小的元素,可推知F为S元素、G为Cl元素,据此解答.
解答 解:A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素;D元素是地壳中含量最多的元素,则D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E元素是短周期元素中金属性最强的元素,则E为Na;F与G的位置相邻,G是同周期元素中原子半径最小的元素,可推知F为S元素、G为Cl元素.
(1)C是氮元素,原子有2个电子层,最外层电子数为5,在元素周期表中的位置:第二周期第VA族,G为Cl元素,原子结构示意图是  ,
,
故答案为:第二周期第VA族; ;
;
(2)D与E按原子个数比1:1形成化合物甲为Na2O2,其电子式为 ,所含化学键类型为:离子键、共价键,
,所含化学键类型为:离子键、共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(3)向过氧化钠中滴加足量水时发生反应的化学方程式是:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径由大到小的顺序是:S2->Cl->Na+,
故答案为:S2->Cl->Na+;
(5)用CH4、O2和NaOH的水溶液组成燃料电池,电极材料为多孔惰性金属电极.在a极通入CH4气体,b极通入O2气体,甲烷发生氧化反应,则a极是该电池的负极,b为正极,氧气在正极获得电子,碱性条件下生成氢氧根离子,正极的电极反应式为:O2+2H2O+4e-═4OH-,
故答案为:负;O2+2H2O+4e-═4OH-.
点评 本题考查结构性质位置关系应用,涉及电子式、核外电子排布、离子半径比较、原电池等,侧重对知识的理解与迁移应用能力考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 合成甲醇:CO+2H2$→_{加热加压}^{催化剂}$CH3OH | |
| B. | 合成乙醛:2CH2=CH2+O2$→_{加热加压}^{催化剂}$2CH3CHO | |
| C. | 合成全降解聚碳酸酯塑料: +nCO2$\stackrel{催化剂}{→}$ +nCO2$\stackrel{催化剂}{→}$ | |
| D. | 合成有机玻璃单体-甲基丙烯酸甲酯:第一步: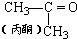 +HCN→(CH3)2C(OH)CN +HCN→(CH3)2C(OH)CN第二步:(CH3)2C(OH)CN+CH3OH+H2SO4→  +NH4HSO4 +NH4HSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (其中n=0、1、2、3)的化合物,式中A、B是任意一种基团(或H原子),W为2价有机基团,又称为该同系列的化合物的系列差,同系列化合物的性质,往往呈现规律性变化,下列四组化合物中,不可称为同系列的是( )
(其中n=0、1、2、3)的化合物,式中A、B是任意一种基团(或H原子),W为2价有机基团,又称为该同系列的化合物的系列差,同系列化合物的性质,往往呈现规律性变化,下列四组化合物中,不可称为同系列的是( )| A. | CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3 | |
| B. | CH3CHCHCHO CH3CHCHCHCHCHO CH3(CHCH)3CHO | |
| C. | CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH 2CHClCH 3 | |
| D. | ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中金属非金属分界处的锗是一种优良的半导体材料 | |
| B. | 砹化银和氯化银一样,不溶于水也不溶于稀硝酸 | |
| C. | 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | Cs与水反应很缓慢,生成的CsOH是一种弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | E1-E2=△H | |
| B. | 该反应为吸热反应 | |
| C. | 升高温度,不影响活化分子百分数 | |
| D. | 使用催化剂使该反应的反应热发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 L乙烯中含C-H键的数目为4NA | |
| B. | 1molFe与足量盐酸反应转移电子数为3NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有的氧原子数目为0.1NA | |
| D. | 向1L 1 mol•L-1氯化铝溶液中加入足量的氨水,生成AlO2-的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质中只含一种元素,该物质一定是纯净物 | |
| B. | H2和D2互为同位素 | |
| C. | 40K和40Ca原子中的质子数和中子数都不相等 | |
| D. | 金刚石和石墨的性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③④⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.
已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com