
 实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为:
实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为:| 浓硫酸 |
| 170℃ |
| ||
| ||


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
| A、将浓硫酸和乙醇混合加热140℃制乙烯 |
| B、用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热,产生砖红色沉淀 |
| C、CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D、苯和浓溴水反应制溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 |
| B、元素性质的周期性变化是指原子核外电子排布、原子半径及元素主要化合价的周期性变化 |
| C、随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化 |
| D、在元素周期表中有些元素既表现出一定的金属性又表现出一定的非金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知实验室制取氯气是用二氧化锰和浓盐酸反应的原理,在收集时,若是用排水法,可能会损失部分氯气.
已知实验室制取氯气是用二氧化锰和浓盐酸反应的原理,在收集时,若是用排水法,可能会损失部分氯气.| 仪器标号 | C | D | E | F | G |
| 仪器 | 洗气瓶 | 洗气瓶 | 硬质玻璃管,加热 | 干燥管 | 干燥管 |
| 仪器中所加物质 | NaOH溶液 | 浓硫酸 | CuO粉末 | 试剂X | 无水CaCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
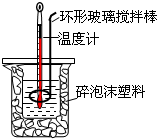 测定中和热实验装置如图:
测定中和热实验装置如图:| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |
 |
 |
 |
 |
 |
| 序号 | a | b | c | d | e | f |

| 温度 实验次数 |
超始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.| 实 验 用 品 | 溶 液 温 度 | 中和热△H(平均值) | ||
| t1 | t2 | |||
| ① | 50mL0.55mol?L-1NaOH 50mL.0.5mol?L-1HCl |
20℃ | 23.3℃ | |
| ② | 50mL0.55mol?L-1NaOH 50mL.0.5mol?L-1HCl |
20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com