
【题目】以下是元素周期表的一部分,根据给定的元素回答下列问题
(1)K的元素符号是;
(2)D元素的外围电子排布图是 , 在其化合物中,最高正价是;
(3)C元素的原子结构示意图是;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是分子(填极性或非极性),B与L(1:1)的化合物的电子式是;
(5)G、H、L原子的第一电离能由高到低的顺序是(填元素符号);
(6)J单质的一种白色同分异构体的空间构型是;
(7)E元素在元素周期表中的位置是 , 在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是 .
【答案】
(1)As
(2)![]() ;+7
;+7
(3)
(4)极性;![]()
(5)N>O>C
(6)正四面体
(7)第四周期第Ⅷ族;Fe3+的3d轨道为半充满结构,更稳定
(8)NaH是离子晶体,H2O是分子晶体
(9)H2﹣2e﹣+2OH﹣=2H2O
(10)Al2O3+6HClO4=2Al(ClO4)3+3H2O
【解析】解:(1)由元素在周期表中位置,可知A为氢,B为Na,C为K,D为Mn,E为Fe,F为Al,G为碳,H为N,L为O,J为P,K为As,M为Cl,N为Ar,所以答案是:As;(2)D处于第四周期VIIB族,外围排布式为3d54s2 , 外围电子排布图为 ![]() ,最高正化合价为+7,所以答案是:
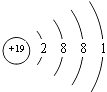
,最高正化合价为+7,所以答案是: ![]() ;+7;(3)C为K元素,原子核外有19个电子,原子结构示意图为:
;+7;(3)C为K元素,原子核外有19个电子,原子结构示意图为: 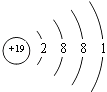 ,所以答案是:
,所以答案是:  ;(4)A与L形成原子数目1:1的化合物是 H2O2 , 为展开书页型结构,为极性分子,B与L形成原子数目1:1的化合物为Na2O2 , 电子式为
;(4)A与L形成原子数目1:1的化合物是 H2O2 , 为展开书页型结构,为极性分子,B与L形成原子数目1:1的化合物为Na2O2 , 电子式为 ![]() ,所以答案是:极性;
,所以答案是:极性; ![]() ;(5)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,所以答案是:N>O>C;(6)J单质的一种白色同分异构体为P4 , 为正四面体结构,所以答案是:正四面体;(7)由位置可知,E元素在元素周期表中的位置是第四周期第Ⅷ族,Fe3+的3d轨道为半充满结构,更稳定,所以答案是:第四周期第Ⅷ族;Fe3+的3d轨道为半充满结构,更稳定;(8)A与B的化合物为NaH,属于离子晶体,A与L的化合物为H2O等,属于分子晶体,故NaH的熔点更高,所以答案是:NaH是离子晶体,H2O是分子晶体;(9)氢气、氧气与NaOH溶液能组成燃烧电池,原电池负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2﹣2e﹣+2OH﹣=2H2O,所以答案是:H2﹣2e﹣+2OH﹣=2H2O;(10)F元素的最高价氧化物为氧化铝,M元素的最高价氧化物的水化物为高氯酸,二者发生反应生成盐与水,反应方程式为:Al2O3+6HClO4=2Al(ClO4)3+3H2O,所以答案是:Al2O3+6HClO4=2Al(ClO4)3+3H2O.
;(5)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,所以答案是:N>O>C;(6)J单质的一种白色同分异构体为P4 , 为正四面体结构,所以答案是:正四面体;(7)由位置可知,E元素在元素周期表中的位置是第四周期第Ⅷ族,Fe3+的3d轨道为半充满结构,更稳定,所以答案是:第四周期第Ⅷ族;Fe3+的3d轨道为半充满结构,更稳定;(8)A与B的化合物为NaH,属于离子晶体,A与L的化合物为H2O等,属于分子晶体,故NaH的熔点更高,所以答案是:NaH是离子晶体,H2O是分子晶体;(9)氢气、氧气与NaOH溶液能组成燃烧电池,原电池负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2﹣2e﹣+2OH﹣=2H2O,所以答案是:H2﹣2e﹣+2OH﹣=2H2O;(10)F元素的最高价氧化物为氧化铝,M元素的最高价氧化物的水化物为高氯酸,二者发生反应生成盐与水,反应方程式为:Al2O3+6HClO4=2Al(ClO4)3+3H2O,所以答案是:Al2O3+6HClO4=2Al(ClO4)3+3H2O.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,且具有较强还原性.下列说法正确的是( )
A.Na2HPO3溶液显碱性,说明HPO32﹣的电离程度大于水解程度
B.25℃时,将0.1 mol?L﹣1的亚磷酸溶液加水稀释后,n(H+)与n(OH﹣)的乘积不变
C.利用H3PO3进行化学镀银,当参加反应的 ![]() =2时,氧化产物为H3PO4
=2时,氧化产物为H3PO4
D.NaH2PO3溶液显酸性,其溶液中存在的粒子浓度关系:c(H2PO3﹣)>c(HPO32﹣)>c(H3PO3)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在研究金属矿物质组分的过程中,发现了Cu﹣Ni﹣Fe等多种金属互化物.
(1)鉴别某种金属互化物是晶体还是非晶体的方法是 .
(2)已知高温下Cu2O比CuO更稳定,试从铜原子核外电子变化角度解释其原因 .
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2 . (SCN)2分子中硫原子的杂化方式是 , σ键和π键数目之比为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,其原因是 .
(4)立方FeO晶体的结构如图1所示,设晶胞边长为a cm,密度为b gcm﹣3 , 则阿伏加德罗常数可表示为(用含a、b的式子表示).人工制备的FeO晶体常存在缺陷(如图2),已知某氧化物样品组成为Fe0.96O,该晶体中Fe3+与Fe2+的离子个数之比为 . 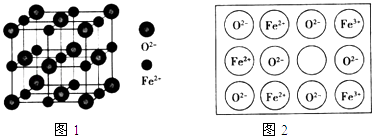
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机高分子合成材料K的合成路线如图(部分反应条件和产物略去)所示.
已知:Ⅰ.RCHO+R′CH2CHO ![]()
![]() +H2O(R,R′表示烃基或氢)
+H2O(R,R′表示烃基或氢)
Ⅱ.RCHO+ ![]()
![]()
 +H2O
+H2O
(1)A是相对分子质量为92的芳香烃,则A的分子式为 , G→H的反应类型为 .
(2)检验E中含氧官能团的试剂为(填名称).
(3)符合下列条件的有机物F的同分异构体有种(不考虑顺反异构);其中核磁共振氢谱中有5组峰,且峰面积之比为3:2:2:2:1的是(写结构简式).①遇FeCl3溶液显紫色;
②能与溴水发生加成反应;
③属于芳香化合物.
(4)写出F和J反应生成K的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是( )
A. 合金的性质与其成分金属的性质不完全相同
B. 工业上金属Mg、Al都是用电解熔融的氯化物制得的
C. 金属冶炼的本质是金属阳离子得到电子变成金属原子
D. 越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.酶的催化条件通常比较温和
B.酶在重金属盐作用下会失去活性
C.DNA是生物体遗传信息的载体、蛋白质合成的模板
D.RNA主要存在于细胞核中,它根据DNA提供的信息控制体内蛋白质的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知如下氧化还原反应2BrO ![]() +Cl2=Br2+2ClO
+Cl2=Br2+2ClO ![]() 5Cl2+I2+6H2O=2HIO3+10HCl ClO
5Cl2+I2+6H2O=2HIO3+10HCl ClO ![]() +5Cl﹣+6H+=3Cl2+3H2O 则下列各微粒氧化能力强弱顺序正确的是( )
+5Cl﹣+6H+=3Cl2+3H2O 则下列各微粒氧化能力强弱顺序正确的是( )
A.ClO ![]() >BrO
>BrO ![]() >IO
>IO ![]() >Cl2
>Cl2
B.BrO ![]() >Cl2>ClO
>Cl2>ClO ![]() >IO
>IO ![]()
C.BrO ![]() >ClO
>ClO ![]() >Cl2>IO
>Cl2>IO ![]()
D.Cl2>BrO ![]() >ClO
>ClO ![]() >IO
>IO ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com