
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
| 20.01+19.99+20.00 |
| 3 |
| 1 |
| 10 |
| 0.02828 |
| 0.15 |


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
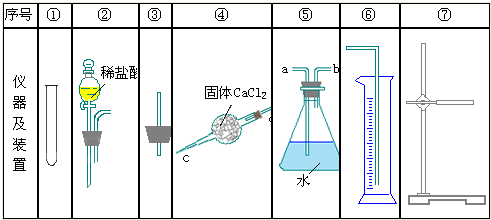
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验操作 | 预期现象与结论 | ||
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液. | 若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-. | ||
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中.往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入______. | ______ | ||
| 步骤3:______ |
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
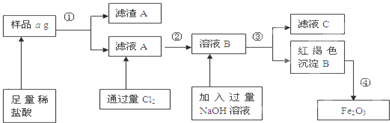
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
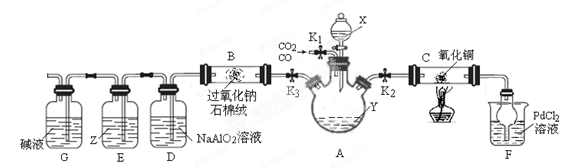
| 组别 | 实验操作 | 实验现象或数据 | 结 论 |
| 甲 | ① 向a g M中加入一定量稀硫酸,充分搅拌; ② 继续滴加稀硫酸至过量, 充分反应. | ①固体明显减少; ②仍然有一定量固体,溶液呈蓝色 | ①M中一定有Cu2O; ②M中一定有Cu. |
| 乙 | 将甲实验后所得溶液过滤 将滤渣洗涤、干燥、称量 | 滤渣质量为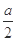 g g | M为Cu和Cu2O的混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com