
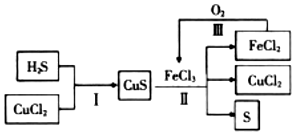
| A. | 在转化过程中化合价不变的元素只有Cu和Cl | |
| B. | 反应II中每生成1.25molS需要2.5molFeCl3 | |
| C. | 在转化过程中能循环利用的物质有FeCl2和CuCl2 | |
| D. | 反应Ⅲ中消耗1molO2时,可转化4mol的FeCl2 |
分析 A.转化过程中Cu元素始终是+2价,Cl元素始终为-1价,H元素始终为+1价;
B.依据元素化合价变化结合氧化还原反应电子守恒计算;
C.物质在过程中参与反应,最后又得到的物质可以循环使用;
D.根据得失电子守恒分析.
解答 解:A.转化过程中Cu元素始终是+2价,Cl元素始终为-1价,H元素始终为+1价,在转化过程中化合价不变的元素有H、Cu和Cl,故A错误;
B.反应II是2FeCl3+CuS=2FeCl2+S+CuCl2,每生成1molS需要2molFeCl3 ,则每生成1.25molS需要2.5molFeCl3,故B正确;
C.FeCl2和CuCl2 在反应中参加反应后又生成,可以循环使用,故C正确;
D.反应Ⅲ中消耗1molO2时,转移4mol电子,转化1molFeCl2需要1mol电子,消耗1molO2时,则可转化4mol的FeCl2,故D正确;
故选A.
点评 本题考查了氧化还原反应、金属性质,主要是铁、铜、硫及其化合物性质的转化关系,掌握基础是解题关键,题目难度不大,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 水能调节人体体温 | B. | 水在人体内分解会放出热量 | ||
| C. | 水是人体内进行生化反应的介质 | D. | 水在人体内是一种良好的溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ?263 | B. | +263 | C. | ?352.1 | D. | +131.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子或分子 | 要求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| C | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| D | Fe3+ Na+、NO3-、ClO- | 溶液pH=l |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
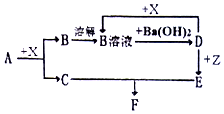 下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略)
下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略) .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa固体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com