
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)依据配制溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等解答.
解答 解:(1)密度为1.84g/mL、质量分数为98%的浓硫酸,物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=100mL×3.0mol/L,解得V=16.3mL;
故答案为:18.4mol/L;16.3;
(2)依据配制溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀可知在第③和第④步操作之间还应该加多一步冷却;
故答案为:冷却.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉有关物质的量浓度计算公式、溶液稀释的规律是解题关键,注意容量瓶在标定温度下测定的体积才准确,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 过氧化钠中阴离子个数为2×6.02×1023 | |
| B. | 14g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023 | |
| C. | 28g C16O与28g C18O中含有的质子数均为14×6.02×1023 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
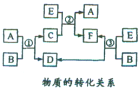 A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.| E的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(F的阴离子)/mol | 1.25 | 1.5 | 2 |
| n(C中的阴离子)/mol | 1.5 | 1.4 | y |
| n(B中的阴离子)/mol | x | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能全部透过半透膜 | B. | 所得物质一定是浊液 | ||
| C. | 所得物质属于纯净物 | D. | 有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | N2(g)+3H2(g)?2NH3(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-808.7 kJ/mol | |
| D. | 2CO(g)?C(s)+CO2(g);△H=-171.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3,H2,CH4 | B. | PCl5,CO2,H2SO4 | C. | SO2,SiO2,P2O5 | D. | CCl4,Na2S,H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com