
| A. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| B. | 将80 g SO3溶于水并配成1 L溶液,溶质的物质的量浓度为1 mol•L-1 | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 1 mol•L-1 NaCl溶液含有NA个Na+ |
分析 A、溶液的物质的量浓度是1mol•L-1,体积1L指的是溶液体积,不是溶剂体积;
B、80g三氧化硫的物质的量为1mol,1mol三氧化硫与水反应生成1mol硫酸;
C、硫酸溶液密度大于1,溶液越稀密度越小,稀释后硫酸的质量分数大于9.8%;
D、1 mol•L-1 NaCl溶液含有Na+的数目还和溶液的体积大小有关.
解答 解:A、58.5gNaCl的物质的量是1mol,溶于水配成1L溶液,得到溶液的摩尔浓度是1mol•L-1,体积1L指的是溶液体积,不是溶剂体积,故A错误;
B、80g三氧化硫的物质的量为:$\frac{80g}{80g/mol}$=1mol,1mol三氧化硫溶于水生成1mol硫酸,则所得溶液浓度为1mol/L,故B正确;
C、10mL质量分数为98%的H2SO4,用水稀释至100mL,由于硫酸溶液的密度大于水的密度,所以稀释后H2SO4的质量分数大于9.8%,故C错误;
D、1 mol•L-1 NaCl溶液含有Na+的数目还和溶液的体积大小有关,体积不知道,数目没法判断,故D错误.
故选B.
点评 本题主要考查了阿伏伽德罗常数的计算,熟练掌握公式的使用和与物质的量之间的关系,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,增加NH3的浓度,反应速率会降低 | |
| B. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 | |
| C. | 其他条件不变,充入氦气,压强增大,化学反应速率增大 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
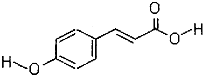
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  的分子式为C17H24O3 的分子式为C17H24O3 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙炔 | |
| C. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH | |
| D. | 完全燃烧等质量的甲醛、乙酸、葡糖糖、蔗糖消耗的氧气量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:
水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:| 相对分子 质量 | 沸点/℃: | 在水中的溶解性 | |
| 甲醇 | 32 | 64.7 | 与水以任何比例相溶 |
| 水杨酸 | 138 | 211 | 0.22g/100ml |
| 水杨酸甲酯 | 152 | 222 | 0.07g/100ml |
 +CH3OH$\stackrel{H+}{?}$
+CH3OH$\stackrel{H+}{?}$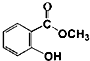 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
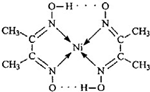 .对该物质的分析判断正确的是( )
.对该物质的分析判断正确的是( )| A. | 该物质是中不存在σ键 | |
| B. | 该物质的分子中只含有共价键、配位键两种作用力 | |
| C. | 该物质是一种配合物,其中N 原子为配位体 | |
| D. | 该物质中C、N、O 原子存在孤对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
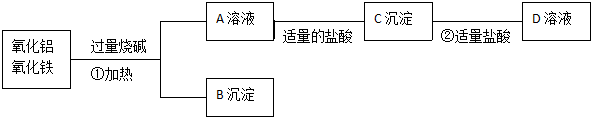
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数相差8的两种短周期元素,其周期序数必相差1 | |
| B. | 氢化锂三兄弟-LiH、LiD、LiT三种物质的质子数之比为4:5:6 | |
| C. | 除零族元素外,短周期元素的最高正价在数值上都等于该元素所属的族序数 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com