
�±��е��������ƻ�1 mol�����еĻ�ѧ�������ĵ�����(kJ):
| ���� | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| ����/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
 2HX(X����Cl��Br��I )�ķ�Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ?��:��______________��
2HX(X����Cl��Br��I )�ķ�Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ?��:��______________�� 
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g) ��H=akJ��mol-1,ƽ�ⳣ��ΪK;
FeO(s)+CO(g) ��H=akJ��mol-1,ƽ�ⳣ��ΪK;
��Ӧ��CO(g)+1/2O2(g) CO2(g) ��H=bkJ��mol-1;
CO2(g) ��H=bkJ��mol-1;
��Ӧ��Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ��H=ckJ��mol-1������ڲ�ͬ�¶���,Kֵ����:
2Fe(s)+3CO2(g) ��H=ckJ��mol-1������ڲ�ͬ�¶���,Kֵ����:
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
 2FeO(s)�Ħ�H= ��
2FeO(s)�Ħ�H= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ĿǰΪֹ���ɻ�ѧ��ת��Ϊ���ܻ������Ȼ������ʹ������Ҫ����Դ��
(1)��ѧ��Ӧ�зų�������(�ʱ䣬��H)�뷴Ӧ����������ڷ�Ӧ�����жϼ����γ��¼����������պͷų������Ĵ�С�йء�
��֪��H2(g)��Cl2(g)=2HCl(g)����H����185 kJ/mol������1 mol H��H�����յ�����Ϊ436 kJ������1 mol Cl��Cl�����յ�����Ϊ247 kJ�����γ�1 mol H��Cl���ų�������Ϊ ��
(2)ȼ��ȼ�ս��������Ļ�ѧ��ת��Ϊ��������Ҫ�����ܡ���֪��
��CH4(g)��2O2(g)=CO2(g)��2H2O(l) ��H����890.3 kJ��mol��1
��C(s��ʯī)��O2(g)=CO2(g) ��H����393.5 kJ��mol��1
�� 2H2(g)��O2(g)=2H2O(l) ��H����571.6 kJ��mol��1
��״̬��22.4 L�����ͼ���Ļ�������������������г��ȼ�շ�Ӧ�ų�588.05 kJ��������ԭ��������������������� ���������������Ȼ�ѧ����ʽ������C(s��ʯī)��2H2(g)=CH4(g)�ķ�Ӧ�Ȧ�HΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ĺ�ҵ�ϳɹ��յij����ƶ������������Ľ���,���ٿƼ�������Ϊ��Ѱ�����۵İ����Ʊ�����,������ǰ����̵�̽���Թ�������ش����и���:
�������͵����ϳɰ���һ�����淴Ӧ,��ѧ����ʽ����:N2+3H2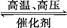 2NH3����֪,�ڳ�����,1 g H2��ȫת��ΪNH3,�ų�������Ϊ15.4 kJ��
2NH3����֪,�ڳ�����,1 g H2��ȫת��ΪNH3,�ų�������Ϊ15.4 kJ��
(1)��д���÷�Ӧ���Ȼ�ѧ����ʽ����
(2)���һ����Ӧ�Ħ�H-T��S<0,��÷�Ӧ�ܹ��Է����С���֪�÷�Ӧ�Ħ�S="-198.2" J��K-1��mol-1�������������ĺϳɷ�Ӧ�ڳ�������������(��ܡ����ܡ�)�Է����С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1����֪����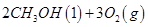 =
= mol
mol
�� =
=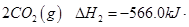 mol
mol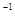
��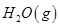 =
=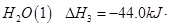 mol
mol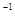
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ ��
��2�������״���ԭ��CO��H2��Դ�����з�Ӧ��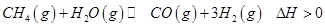
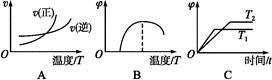
��һ��������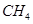 ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼa����
��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼa����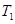
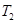 (�<������>����="����ͬ)��A��B��C���㴦��Ӧƽ�ⳣ��(
(�<������>����="����ͬ)��A��B��C���㴦��Ӧƽ�ⳣ��(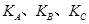 )�Ĵ�С��ϵΪ ��
)�Ĵ�С��ϵΪ ��
��100��ʱ����1 mol 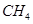 ��2 mol
��2 mol 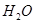 ͨ���ݻ�Ϊ1L�Ķ����ܱ������з�����Ӧ����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���� (�����)��
ͨ���ݻ�Ϊ1L�Ķ����ܱ������з�����Ӧ����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���� (�����)��
a��������ѹǿ�㶨
b����λʱ��������0.1 mol CH4ͬʱ����0.3 molH2
c�������������ܶȺ㶨
d��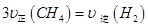
����ﵽƽ��ʱ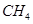 ��ת����Ϊ0��5����100��ʱ�÷�Ӧ��ƽ�ⳣ��K= ��
��ת����Ϊ0��5����100��ʱ�÷�Ӧ��ƽ�ⳣ��K= ��
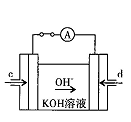
��3��ijʵ��С������CO(g)��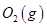 ��KOH(aq)��Ƴ���ͼb��ʾ�ĵ��װ�ã���õ�ظ����ĵ缫��ӦʽΪ ��
��KOH(aq)��Ƴ���ͼb��ʾ�ĵ��װ�ã���õ�ظ����ĵ缫��ӦʽΪ ��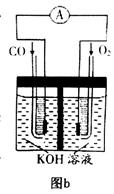
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ժ������ʵ��о����������ż�Ϊ��Ҫ�����塣
��1��N2��O2��H2�֮����Է������Ϸ�Ӧ����֪��Ӧ���Ȼ�ѧ����ʽ���£�
N2(g)+O2(g)=2NO(g) 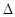 H=+180��5kJ��mol-1��
H=+180��5kJ��mol-1��
2H2(g)+O2(g)=2H2O(g) 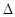 H =-483��6 kJ��mol-1��
H =-483��6 kJ��mol-1��
N2(g)+3H2(g)=2NH3(g) 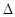 H =-92��4 kJ��mol-1��
H =-92��4 kJ��mol-1��
�Ĵ�������Ӧ���Ȼ�ѧ����ʽΪ ��
��2������β��������һ����Ӧԭ��Ϊ��2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g) 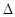 H<0��
H<0��
һ���¶��£���2��8mol NO��2��4mol COͨ��̶��ݻ�Ϊ2L���ܱ������У���Ӧ�����в������ʵ����ʵ����仯��ͼ��ʾ��
��NO��ƽ��ת����Ϊ ��0~20minƽ����Ӧ����v(NO)Ϊ ��25minʱ�������ַ�Ӧ�¶Ȳ��䣬���������г���CO��N2��0��8 mol����ѧƽ�⽫ �ƶ�(����������ҡ�����)��
����ֻ�ı�ijһ��Ӧ����X����Ӧ��ԭƽ��I�ﵽ��ƽ��II������Y�ı仯��������ͼ��ʾ������˵����ȷ���� (����ĸ����)��
|
 ��3��ij��ѧС���������N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ�Ƴ�ȼ�ϵ�أ���õ�ص�������ӦʽΪ ������������Һ��������䣬����˵����ȷ���� (����ĸ����)��
��3��ij��ѧС���������N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ�Ƴ�ȼ�ϵ�أ���õ�ص�������ӦʽΪ ������������Һ��������䣬����˵����ȷ���� (����ĸ����)�� 1023�����ӣ����б�״����11��2L�缫��Ӧ�ﱻ����
1023�����ӣ����б�״����11��2L�缫��Ӧ�ﱻ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������Ϊһ������Դ�ڻ�ѧ����Ӧ�ù㷺����ش��������⣺
(1)��¯ұ�������У������ڴ���Ӧ���в���ˮú��(CO��H2)��ԭ���������йط�ӦΪ��CH4(g)��CO2(g)=2CO(g)��2H2(g)����H��260 kJ��mol��1
��֪��2CO(g)��O2(g)=2CO2(g)����H����566 kJ��mol��1
��CH4��O2��Ӧ����CO��H2���Ȼ�ѧ����ʽΪ_____________________��
(2)����ͼ��ʾ��װ�â�Ϊ����ȼ�ϵ��(�������ҺΪKOH��Һ)��ͨ��װ�â�ʵ�������϶�ͭ��
��a��Ӧͨ��________(�CH4����O2��)��b���缫�Ϸ����ĵ缫��Ӧʽ��________��
�ڵ�ƽ�����װ�â�����Һ��pH________(��д�������С�����䡱����ͬ)��װ�â���Cu2�������ʵ���Ũ��________��
�۵�ƽ�����װ�â���Һ�е������ӳ���OH���������________(����ˮ��)��
���ڴ˹���������ȫ��Ӧ��װ�â������������仯12.8 g����װ�â������������ļ���________L(��״����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
̼��̼�Ļ�����㷺�Ĵ��������ǵ������С�
��1���������з�Ӧ�������仯ʾ��ͼ��2C(s) +O2(g) =2CO(g) ��H= ��
��2�������Ϊ2L���ܱ������У�����1 mol CO2��3mol H��һ�������·�����Ӧ�� CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H<O���CO2(g)��CH3OH(g)�����ʵ�����ʱ��仯��������ͼ��ʾ��
CH3OH(g)+H2O(g) ��H<O���CO2(g)��CH3OH(g)�����ʵ�����ʱ��仯��������ͼ��ʾ��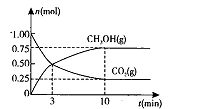
�ٴӷ�Ӧ��ʼ��ƽ�⣬H2O��ƽ����Ӧ����v(H2O)= ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����� �����ţ���
A�������¶� B����CH3OH��g����ʱҺ���Ƴ�
C��ѡ���Ч���� D���ٳ���l mol CO2��4 mol H2
��3��CO2����ˮ����̼�ᡣ��֪�������ݣ�
| ������� | H2CO3 | NH3��H2O |
| ����ƽ�ⳣ���� 25�棩 | Ka1 = 4��30 �� 10һ7 Ka2= 5��61�� 10һ11 | Kb = 1��77�� 10һ5 |
 ˮ���ƽ�ⳣ��Kh=Kw/Kb��
ˮ���ƽ�ⳣ��Kh=Kw/Kb��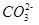
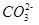 ������һ��ˮ������ӷ���ʽ ��
������һ��ˮ������ӷ���ʽ ��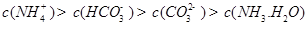

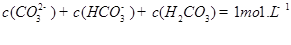
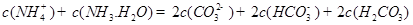
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����������������йط�Ӧ���ʱ䣺
��1����֪��Ti(s)��2Cl2(g)=TiCl4(l)��H����804��2 kJ��mol��1
2Na(s)��Cl2(g)=2NaCl(s)����H����882��0 kJ��mol��1
Na(s)=Na(l)����H����2��6 kJ��mol��1
��ӦTiCl4(l)��4Na(l)=Ti(s)��4NaCl(s)�Ħ�H��________ kJ��mol��1��
��2����֪���з�Ӧ��ֵ��
| ��Ӧ��� | ��ѧ��Ӧ | ��Ӧ�� |
| �� | Fe2O3(s)��3CO(g)= 2Fe(s)��3CO2(g) | ��H1����26��7 kJ��mol��1 |
| �� | 3Fe2O3(s)��CO(g)=2Fe3O4(s)��CO2(g) | ��H2����50��8 kJ��mol�� |
| �� | Fe3O4(s)��CO(g)=3FeO(s)��CO2(g) | ��H3����36��5 kJ��mol��1 |
| �� | FeO(s)��CO(g)=Fe(s)��CO2(g) | ��H4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com