
| 选项 | 性质 | 实际应用 |
| A. | 生石灰具有吸水性 | 生石灰用作袋装食品的抗氧化剂 |
| B. | 碳酸钠能与盐酸反应 | 碳酸钠可用作治疗胃酸过多的药剂 |
| C. | 氢氟酸能与硅酸钠反应生成硅酸 | 氢氟酸可用于雕刻玻璃 |
| D. | Al2O3熔点非常高 | 氧化铝用作耐高温材料 |
| A. | A | B. | B | C. | C | D. | D |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
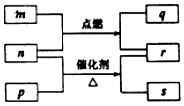 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )| A. | 原子半径:Y<X<Z | B. | 非金属性:Y>X>W | ||
| C. | m与q、n与s均不能共存 | D. | 若n过量,q还可以继续燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 一定条件下,铁粉可与水蒸气反应生成四氧化三铁和氢气 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 纯铁的硬度和熔点均低于铁合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl晶体 | B. | Zn粉 | C. | SO3固体 | D. | CuSO4晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L - 1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L - 1KOH溶液,下列说法中正确的是( )| A. | 放电时K +移向负极 | |
| B. | 放电时电池负极的电极反应为H 2-2e -═2H + | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H 2O+e -═Ni(OH) 2+OH - | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com