
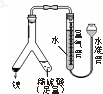
 用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )
用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )| A、将水准管上提,液面高于量气管且不下降,说明装置不漏气 |
| B、可用来测定镁的相对原子质量 |
| C、读取气体体积时水准管的水面高于量气管的水面,可导致测定结果偏高 |
| D、金属镁中含有少量杂质铝,可导致测定结果偏高 |
| V |
| Vm |
| V |
| Vm |
| m |
| n |
| 24V |
| m |
| 24V |
| m |


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
| A、相同温度下,在水中的溶解度:Na2CO3<NaHCO3 |
| B、热稳定性:Na2CO3>NaHCO3 |
| C、都能与足量盐酸反应放出CO2,但产生气体的物质的量不相同 |
| D、与相同浓度的盐酸反应放出CO2的速率Na2CO3大于NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
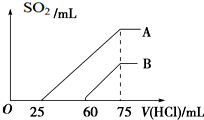 向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 min末时A和B的浓度之比为5:3 |
| B、x=2 |
| C、2 min末时B的浓度为1.5 mol?L-1 |
| D、2 min末时A的消耗浓度为0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、研制常温下分解水制取氢能的催化剂 |
| B、提高煤液化制取汽油的技术水平 |
| C、推广汽车用燃料以天然气替代汽油 |
| D、研究提高汽油燃烧热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.1g | B、4.2g |
| C、3.6g | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
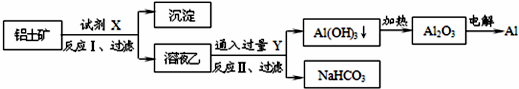
| A、试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C、结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A、2~3s间的平均反应速率v(NO)=9×10-5mol/(L?s) |
| B、催化转化器对废气的转化速率在夏季时比冬季时高 |
| C、若该催化转化器气舱容积为2L,则达到平衡时反应放出热量1.8a J |
| D、该温度下,此反应的平衡常数K=5000 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com