
����Ŀ���ܣ�Co��������������Ԫ�ء����ܻ�������Ϊ���ϣ������ƾõ���ʷ���ڻ�е���졢���Բ��ϵ�����Ҳ���й㷺��Ӧ�á���ش��������⣺
��1��Co��̬ԭ�ӵ���Χ�����Ų�ʽΪ ��

��2��̪ݼ���������ڹ����ϡ������Թ�ѧ���ϡ����ѧ�Ʒ��еĹ������������ȷ���õ��˹㷺��Ӧ�á���ṹ��ͼ��ʾ����������Ϊ�����ӡ�
��̪ݼ�������ַǽ���ԭ�ӵĵ縺���ɴ�С��˳��Ϊ ��
������Ӧ��Ԫ�ط������𣩣�̼ԭ�ӵ��ӻ��������Ϊ ��
����������ͨ����λ����ϵĵ�ԭ�ӵı���� ��
��3��Co��һ��������ľ�������ͼ��ʾ���ڸþ�������һ����ԭ�ӵȾ������������ԭ����_________�����������Ͽ�ѧ����ʵ����һ������С�鷢������ 5K �³��ֳ����Եľ��壬�þ������CoO2�IJ�״�ṹ(����ͼ��ʾ��С���ʾCoԭ�ӣ������ʾOԭ�ӣ��������ô��������ظ��ṹ��Ԫʾ��ͼ��������CoO2�Ļ�ѧ��ɵ��� ��


���𰸡���1��3d74s2����2����N>C>H �� sp2�� ��2��4 ����3��12 ��D .
��������
���������Co��27��Ԫ�ػ�̬ԭ�ӵ���Χ�����Ų�ʽΪ3d74s2����Ϊ��3d74s2����2����̪ݼ�������ַǽ���ԭ�ӷֱ�ΪH��C��N���縺���ɴ�С��˳��ΪN>C>H���ṹ�п��Կ������е�̼ԭ�ӵļ۲���Ӷ�����Ϊ3���ӻ���ʽΪsp2�ӻ�����Ϊ��N>C>H �� sp2�� �ں��й¶Ե��ӵ�Nԭ����Coͨ����λ����ϣ��γ���λ�����γ�4�Թ��õ��Ӷԣ��γ�3�Թ��õ��ӶԵ�Nԭ���γ���ͨ�Ĺ��ۼ���1��3��Nԭ���γ�3�Թ��õ��Ӷ�Ϊ��ͨ���ۼ���2��4��Nԭ���γ�4�Թ��õ��Ӷԣ���Coԭ��ͨ����λ����ϣ���Ϊ��2��4 ����3���������ܾ����ṹ��֪������Co��Oԭ����Ŀ��Ϊ1:1�������ɫ����Coԭ�ӣ��Զ�����ԭ��Ϊ�о�������֮�����Coԭ��λ�����ģ�ÿ������8���������ã�ÿ������Ϊ2���������ã��ڸþ�������һ��Coԭ�ӵȾ��������Coԭ�ӵĸ���Ϊ3x8/2=12��CoO2�ظ��ṹ��Ԫ��Co��Oԭ�Ӹ�����Ϊ1:2����ͼ��A.��Co��Oԭ�Ӹ�����Ϊ1:4x1/2=1:2�����ϣ�B. ��Co��Oԭ�Ӹ�����Ϊ(1+4x1/4):4=1:2�����ϣ�C. ��Co��Oԭ�Ӹ�����Ϊ4x1/4:4x1/2=1:2�����ϣ�D. ��Co��Oԭ�Ӹ�����Ϊ4x1/4:1=1:1�������ϣ���Ϊ��12��D.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣����еı�Ŵ�������Ӧ��Ԫ�ء���ش��������⣺

��1������Ԫ�صĻ�̬ԭ�ӵļ۵����Ų�ʽ��_________________������ͬ���ڣ��һ�̬ԭ�ӵĺ���δ�ɶԵ���������Ԫ����_______________(д��Ԫ�ط���)��
��2������������Ԫ���γɵ���������۵��ɸߵ��͵���_________________��
��3������������Ԫ���γɵĺ���18���ӵķ���Ϊ___________(д������)���÷�������Ԫ�ص�ԭ�ӵ��ӻ���ʽΪ______________����������������Ԫ�ص�ԭ���γɵľ��壬�侧���Ľṹ�ص���ͼ��ʾ����û�����Ļ�ѧʽΪ______________(�ö�Ӧ��Ԫ�ط��ű�ʾ)��

��4���±���ijЩ������Ԫ�صĵ縺��ֵ��
Ԫ�ط��� | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
Xֵ | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.58 | 2.5 | 3.1 |
��ͨ�������縺��ֵ�仯���ɣ�ȷ��N��ӽ��ĵ縺��ֵ��Χ��________��N��__________
���Ʋ�縺��ֵ��ԭ�Ӱ뾶��ϵ��____________________��
�����жϣ�AlBr3�л�ѧ��������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ؿ�������������������ѧ��ѧ����������������ҵ�ϣ������̿��Ƹ�����ص��������£�

��ش��������⣺
��1������������Ҫ������CO2���壮д��ʵ������ȡCO2�Ļ�ѧ����ʽ ��
��2��KMnO4ϡ��Һ��һ�ֳ��õ���������������ԭ��������������ͬ���� ������ĸ����
a��75%�ƾ� b��˫��ˮ c������ d�� 84����Һ��NaClO��Һ��
��3��д���������̺�����������������ͨ�����ʱ��������Ҫ��ѧ��Ӧ�ķ���ʽ�� ��
��4�����������п���ѭ��ʹ�õ������� �� ��д��ѧʽ����
��5���ⶨ���������Ʒ���Ȳ��������̵ζ�������������Һ�еμ���������Һ��������ɫ����������Һ���Ϻ�ɫ�պ���ɫ�Ұ���Ӳ��ָ��������ﵽ�ζ��յ㡣д���÷�Ӧ�����ӷ���ʽ�� ��
��6����֪�������£�Ksp[Mn��OH��2]=2.4��10-13����ҵ�ϣ�����pH���Գ�����ˮ��Mn2+����pH=10ʱ����Һ��c��Mn2��= ___________________��
��7��������������� �����������KMnO4��K2CO3���������ܽ����ϵIJ��죬���� ����������裩�����ȹ��˵õ�KMnO4�־��壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(K2FeO4)��һ�����͡���Ч�����ˮ���������Ҳ�����ɶ�����Ⱦ����֪�����������ȶ��Բ���������ڼ��Ի����б����Ի���������ȶ�����ҵ����ʪ���Ʊ�������صĻ�����������ͼ��ʾ��

�����й�˵������ȷ����
A�����Ʒ�Ӧ�¶�30�����µ�ԭ������ֹ���ɵ�K2FeO4�����ֽ�
B���ᾧ�����м���ŨKOH��Һ������������K��Ũ�ȣ��ٽ�K2FeO4��������
C����Һ2�������ӿ�ͨ����ɫ��Ӧ����ȷ��
D��ʪ���Ʊ�������أ�Ҳ������Fe(OH)3�Ͻ���ֱ��ͨ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����16�֣�����β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����
��1��2NO��g��+2CO��g��2CO2��g��+N2��g����H=��746.5KJ/mol ������Ϊʹ�ô�����
��֪��2C ��s��+O2��g��2CO��g����H=��221.0KJ/mol
C ��s��+O2��g��CO2��g����H=��393.5KJ/mol
��N2��g��+O2��g��=2NO��g����H= kJmol��1��
��2��T���£���һ�ݻ�������ܱ������У�ͨ��һ������NO��CO�������崫������ò�ͬʱ��NO��CO��Ũ�����±�
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 | |||||||
C��NO��10��4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 | |||||||
C��CO��10��3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 | |||||||
��C2��������ֵΪ ������ĸ��ţ���
A��4.20 B��4.00 C��2.95 D��2.80
��3������ͬ���ʵ�����H2O��g����CO��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��H2O��g��+CO��g��CO2��g��+H2��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
��a=2��b=1����c= ����ƽ��ʱʵ����ii��H2O��g����ʵ����iii��CO��ת���ʵĹ�ϵΪ��ii��H2O�� ��iii��CO�������������������=������
��4���������������Դ����CO�ڴ����������Ʊ������ѵķ�Ӧԭ��Ϊ��2CO��g��+4H2��g��CH3OCH3��g��+H2O��g������֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�![]() �ı仯������ͼ1��ʾ��
�ı仯������ͼ1��ʾ��
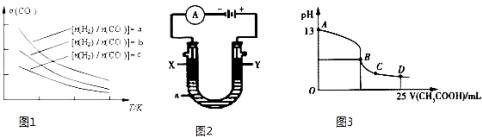
��a��b��c���Ӵ�С��˳������Ϊ ��
������ͼ������жϸ÷�ӦΪ���ȷ�Ӧ�������� ��
��5��CO�����Ĵ������ɲⶨ����β���Ƿ�����ŷű����÷����ǵĹ���ԭ��������ȼ�ϵ�أ����е�����������ƣ�Y2O3��������ﯣ�ZrO2�����壬�ܴ���O2����
�����ĵ缫��ӦʽΪ ��
�����������Ϊ��Դ��ͨ���������ӳ�ͼ2����X��YΪʯī��aΪ2L 0.1mol/L KCl��Һ���һ��ʱ���ȡ25mL �����������Һ���μ�0.4mol/L����õ�ͼ3���ߣ�������������ʧ����������ˮ����Һ����仯���Բ��ƣ�������ͼ�����㣬������������ ����һ����̼������Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ͼ���о�������������Ӧ��ʵ��װ��ͼ
��1�����о������������ķ�Ӧ������Ҫ�������� ��
��2�����ȼ����� ��ͬ���칹�塣
��3�������һ�ȼ���������������Ӧ�Ļ�ѧ����ʽ��CH3Cl+Cl2![]() +HCl���÷�Ӧ���ڷ�Ӧ �����л���Ӧ���ͣ���
+HCl���÷�Ӧ���ڷ�Ӧ �����л���Ӧ���ͣ���
��.��4��1molij������ȫȼ������8molO2�����仯ѧʽΪ ��д��������ͬ���칹����֧������������ϵͳ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W��V��U�Ƕ����ڵ�����Ԫ�أ�ԭ��������������X��Vͬ���壬����W�����γ�A2B��A2B2�ͻ����Z��W�ĵ��ʳ����¾�Ϊ��ɫ���壻Y��Uͬ������Yԭ�ӵ�L���������K���������2�����Իش��������⣺
��1��д��UԪ�������ڱ��е�λ�� ��V���ӽṹʾ��ͼΪ ��YW2�ĵ���ʽ ��
��2��Y��U�ļ��⻯����ȶ���������ǿ��˳���� ��
��3��V������������ˮ���ﲻ��ʹ�ò������Լ�ƿʢ�ŵ�ԭ���� �����û�ѧ����ʽ��ʾ��
��4����X��Z��ɵ�һ�ֻ����ﻯѧʽΪZX5�����ԭ�Ӿ��ﵽͬ����ϡ������ԭ�ӵ��ȶ��ṹ������������ (��������������������)�����
��5��X��Y��Z��W����Ԫ�أ���˳�����ԭ�Ӹ�����Ϊ5��1��1��3�Ļ�����û������ϡ��Һ����������������Һ�ڼ��������·�Ӧ�����ӷ���ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������Ҫ�ɷ�Ϊ��Ҫ�ɷ���Al2O3��������SiO2��Fe2O3����ȡ��������ұ��Al�IJ����������£�

��1������A�� ������B�� ��
��2������I��II��III�ķ�������������� ��
��3������IV������ʱʢ��ҩƷ������������ ��������Ӧ�Ļ�ѧ����ʽ�� ��
��4������III�з�����Ӧ��������C�����ӷ���ʽ��ʾΪ ��
��5��ȡ��ҺB100mL������1molL-1����200mLʱ���������ﵽ���������Ϊ11.7g������ҺB��c��Al��(OH)4��-��= ,c��Na+���� mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[���ʽṹ������]
��֪̼Ԫ�����γɶ��ֽ���̼�����̼���ƣ��׳�Ϊ��ʯ��
��1����ʯ��CaC2������CaO�뽹̿�ڵ�¯�м�ǿ�ȷ�Ӧ���ɵģ�д���˷�Ӧ�Ļ�ѧ����ʽ ��CaC2�к��л�ѧ��������Ϊ ��C22����N2��Ϊ�ȵ����壬C22���ĵ���ʽ�ɱ�ʾΪ ������������������Ŀ֮��Ϊ ��
��2����֪MgO��CaO���۵�ֱ�Ϊ2852�桢2614�棬�����۵�����ԭ���� ��
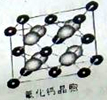
��3������������һ����Ҫ�İ����ᣬ��ṹ��ͼ��ʾ�������е�һ����������ԭ�Ӽ۵����Ų�ʽ�� ������̼ԭ�ӵ��ӻ���ʽ�� ��
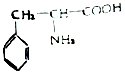
��4����֪CaF2���壨��ͼ��Ca2���������ģ����ܶ�Ϊ��g/cm3��NAΪ�����ӵ³��������ڵ�����Ca2���ĺ˼��Ϊa cm����CaF2��Ħ��������M�����Ա�ʾΪ g/mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com