
分析 (1)氢离子浓度越大,溶液的pH越小,弱电解质部分电离,强电解质完全电离,弱电解质的浓度越大,氢离子浓度越大,据此pH溶液pH大小;酸溶液中,氢离子浓度越大,水的电离程度越小,水电离出的c(H+)最大,则酸溶液中氢离子浓度最小;锌足量,生成氢气的量取决于溶质中含有的氢离子的总物质的量;
(2)醋酸电离吸热,反应放出的热量减少.
解答 解:(1):①100mL 0.1mol•L-1H2SO4溶液中氢离子浓度为0.2mol/L;
②100mL 0.15mol•L-1盐酸中氢离子浓度为0.15mol/L;
③100mL 0.2mol•L-1的醋酸中,醋酸部分电离,则氢离子浓度小于0.2mol/L;
④200mL 0.1mol•L-1的醋酸中氢离子浓度小于0.1mol/L;
根据分析可知,各溶液中氢离子浓度最大的为①,则溶液的pH最小的为①;
四种溶液中,氢离子浓度最小的为④,则④对水的电离的抑制程度最小,其溶液中水电离的氢离子浓度最大;
①100mL 0.1mol•L-1H2SO4溶液中能够提供的氢离子的总物质的量为:0.1mol/L×2×0.1L=0.02mol;
②100mL 0.15mol•L-1盐酸中能够提供的氢离子的物质的量为:0.15mol×0.1L=0.015mol;
③100mL 0.2mol•L-1的醋酸中最多能够提供氢离子:0.2mol/L×0.1L=0.02mol;
④200mL 0.1mol•L-1的醋酸中能够提供的氢离子的物质的量为:0.1mol/L×0.1L=0.02mol;
根据分析可知,能够提供氢离子的物质的量最小的为②,则与足量锌反应生成氢气最少的为②,
故答案为:①;④;②;
(2)100mL 0.1mol•L-1H2SO4溶液,100mL 0.2mol•L-1 CH3COOH溶液分别与100mL 0.2mol•L-1NaOH溶液反应,醋酸电离吸热,所以醋酸反应放出的热量较少;
故答案为:③.
点评 本题考查了溶液pH的计算、弱电解质的电离及其影响,题目难度中等,明确溶液pH的表达式为解答关键,注意掌握弱电解质的电离平衡及其影响因素,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ④⑤⑥ | C. | ①③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
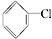 ②
②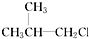 ③(CH3)3CCH2Cl ④CHCl2CHBr2⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2⑤ ⑥CH3Cl.
⑥CH3Cl.| A. | 全部 | B. | ②③⑤ | C. | ①③⑥ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属中Li的还原性最强 | B. | 碱金属阳离子,氧化性最强的是Li+ | ||
| C. | 和Li同一主族的都是金属元素 | D. | Li在空气中加热生成过氧化锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | CH3CH2CHO | ||
| C. | CH3CH=CHCH2CH2CH3 | D. | CH3CH2CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
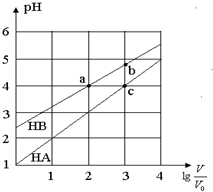 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({B}^{-})}{c({A}^{-})}$减小 | |
| C. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| D. | 溶液中水的电离程度:a=c>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,画出k元素的离子结构示意图
,画出k元素的离子结构示意图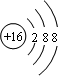
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | H2O2是由极性共价键和非极性共价键构成的非极性分子 | |
| C. | 两种酸溶液充分反应后的体系不可能为中性 | |
| D. | 碳、氮形成的氢化物常温下都是气态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com