
| A. | Na+、Mg2+、OH-、NO3- | B. | Al3+、NH4+、Br-、Cl- | ||
| C. | K+、HCO3-、Ca2+、SO42- | D. | Na+、K+、SiO32-、Cl- |
科目:高中化学 来源: 题型:选择题
| A. | 将金属钠保存在煤油中 | |
| B. | 少量的白磷可保存在水中 | |
| C. | 纯碱溶液用带磨口玻璃瓶塞的试剂瓶保存 | |
| D. | 硝酸银溶液盛放在棕色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁做阳极材料电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 碱性甲烷燃料电池的负极反应式:CH3OH-6e-+6OH-═CO2+5H2O | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-→Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,上层液体从下口放出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中溶质微粒一定不带电,胶体中分解质微粒带有电荷 | |
| B. | 溶液呈电中性,胶体带电荷 | |
| C. | 胶体是比溶液更稳定的分散系 | |
| D. | 胶体是一种较稳定的分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
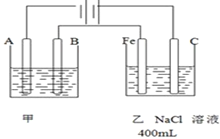
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com