
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:分析 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式[Ar]3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素,据此解答.
解答 解:有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式[Ar]3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素,
(1)E是铜元素,根据构造原理知,其基态原子的价电子排布式[Ar]3d104s1,故基态Cu原子的价电子排布式为:3d104s1,
故答案为:3d104s1;
(2)氮气的结构式为:N≡N,所以氮气分子中含有一个σ键两个π键,1molA的单质分子中π键的个数为:1.204×1024,
故答案为:1.204×1024;
(3)同一周期中,元素的第一电离能随着原子序数的增大呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能大于同周期相邻元素,素第一电离能由大到小的顺序为:F>N>O,
故答案为:F>N>O;
(4)N元素的简单氢化物是氨气,NH3分子中氮原子价层电子对=3+$\frac{5-1×3}{2}$=4,且含有一个孤电子对,所以分子空间构型是三角锥形,
故答案为:三角锥形;
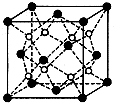
(5)F和Ca形成的化合物为CaF2,由晶胞结构可知,晶胞中白色球数目=8、黑色球数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,白色球为F、黑色球为Ca,则晶胞质量=4×$\frac{78g}{{N}_{A}}$=$\frac{312}{{N}_{A}}$g,晶胞的体积=$\frac{\frac{312}{{N}_{A}}g}{ρg•c{m}^{-3}}$=$\frac{312}{ρ•{N}_{A}}$cm3,故晶胞边长为:a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{312}{ρ•{N}_{A}}}$.
点评 本题考查晶胞计算,涉及核外电子排布、分子空间构型、化学键、杂化方式、电离能、晶胞计算等,都是考试热点,注意第一电离能的变化趋势及异常现象,为易错点.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 将NaOH放在天平左边托盘中的纸片上 | |
| B. | 将NaOH放入烧杯中(烧杯事先已称重),并放在天平左边托盘上 | |
| C. | 用镊子取出标定为10.1 g的砝码放在天平右边的托盘上 | |
| D. | 用镊子取出标定为10 g的砝码放在天平左边的托盘上,并将游码向右移到0.1 g位置上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
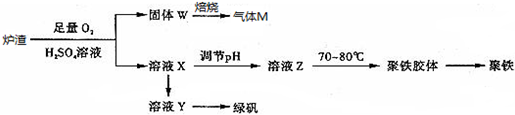
| A. | 炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O | |
| B. | 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大 | |
| C. | 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用 | |
| D. | 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下:
实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
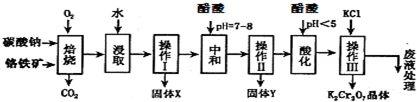
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价:F>O>N>C | B. | 离子半径:F->O2->Na+>Al3+ | ||
| C. | 热稳定性:PH3<H2S<HCl<HF | D. | 单质的还原性:Al>Mg>Na>K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com