
 测定生成气体的体积为69.44L(标准状况)
测定生成气体的体积为69.44L(标准状况) 过滤,测定沉淀的质量为5.8g
过滤,测定沉淀的质量为5.8g

科目:高中化学 来源:不详 题型:单选题
| A.两反应中转移的电子数相等 |
| B.消耗NaOH溶液和盐酸的体积不相等 |
| C.消耗铝的质量相等 |
| D.反应后两溶液混合会产生白色沉淀且溶液中的溶质只有NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1︰1 | B.3︰2 | C.2︰3 | D.28︰9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
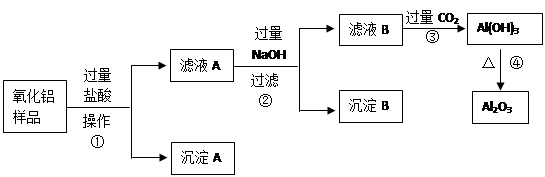
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:2 | B.1:1 | C.1:3 | D.2:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com