
【题目】铋及其化合物在冶金、医疗、化工生产中均有重要作用。铋在自然界中的含量极少,常以游离金属和矿物的形式存在。对浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2、Cu2S、FeS2等杂质)通过浸出、净化和电沉积法分离回收铋的流程:
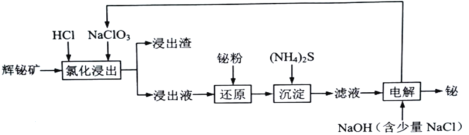
已知:I.“氯化浸出”过程中,需分批多次加入NaClO3,以防生成Cl2;
II.BiCl3极易水解生成不溶性的BiOCl沉淀,但在浓盐酸中几乎不水解;
III.氧化性:Fe3+>Cu2+>Bi3+>H+.
请回答以下问题:
(1)“氯化浸出”时,为了提高浸取速率,可采取的措施有________________(任写一条);加入过量盐酸的主要目的是______________________.
(2)浸出渣中含有S和____________(写化学式);
(3)写出“氯化浸出”中Bi2S3所发生反应的离子方程式__________________________.
(4)“还原”过程中所发生反应的离子方程式为2Bi+3Cu2+=2Bi3++3Cu及____________。
(5)“电解”过程的简易装置如图所示。装置中N为电源的________(填“正”或“负”)极;阳极上发生的主要电极反应式为__________________________。

【答案】粉碎矿石(或适当提高浸取时温度合理答案) 抑制BiCl3水解生成不溶性沉淀,提高铋的浸出率 SiO2 ClO![]() +Bi2S3+6H+=3S↓+Cl-+2Bi3++3H2O Bi+3Fe3+=Bi3++3Fe2+ 负 Cl--6e-+6OH-=ClO
+Bi2S3+6H+=3S↓+Cl-+2Bi3++3H2O Bi+3Fe3+=Bi3++3Fe2+ 负 Cl--6e-+6OH-=ClO![]() +3H2O
+3H2O
【解析】
辉铋矿(主要成分为Bi2S3,还含少量Bi2O3、SiO2、Cu2S、FeS2等杂质)加入盐酸调节pH,并加入NaClO3,发生反应:Bi2S3+NaClO3+6HCl=2BiCl3+3S+NaCl+3H2O、Bi2O3+6HCl=2BiCl3+3H2O,3Cu2S+2NaClO3+12HCl=6CuCl2+3S+2NaCl+6H2O、2FeS2+NaClO3+6HCl=2FeCl3+4S+NaCl+3H2O,SiO2不溶,得到浸出渣为SiO2和S,滤液中加入铋粉还原铁离子:3Fe3++Bi=Bi3++3Fe2+,加入硫化氨沉淀Cu2+,则净化液中阳离子含有Bi3+、H+和NH4+、Na+、Fe2+,将净化液与混有少量的氢氧化钠溶液电解得到铋,则石墨电极净化液的电极反应为:Bi3++3e-=Bi,发生还原反应,作阴极,故钛板为阳极发生氧化反应:Cl--6e-+6OH-=ClO![]() +3H2O,c为阴离子交换膜,据此分析解答。
+3H2O,c为阴离子交换膜,据此分析解答。
(1)“氯化浸出”时,为了提高浸取速率,可采取的措施有粉碎矿石(或适当提高浸取时温度合理答案);浸出液中含有Bi3+,结合已知信息II,BiCl3极易水解生成不溶性的BiOCl沉淀,但在浓盐酸中几乎不水解,则加入过量盐酸的主要目的是抑制BiCl3水解生成不溶性沉淀,提高铋的浸出率
(2)根据分析,浸出渣中含有S和SiO2;
(3)根据分析,“氯化浸出”中Bi2S3所发生反应的离子方程式ClO3—+Bi2S3+6H+=3S↓+Cl-+2Bi3++3H2O;
(4)“还原”过程中所发生反应的离子方程式为2Bi+3Cu2+=2Bi3++3Cu;及铋粉还原铁离子,离子方程式为:3Fe3++Bi=Bi3++3Fe2+;
(5)根据分析,净化液中阳离子含有Bi3+、H+和NH4+、Na+、Fe2+,将净化液与混有少量的氢氧化钠溶液电解得到铋,则石墨电极净化液的电极反应为:Bi3++3e-=Bi,发生还原反应,作阴极,电解池中阴极与电源的负极相连,则N为负极;钛板为电解池阳极发生氧化反应:Cl--6e-+6OH-=ClO3—+3H2O。


科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,可逆反应N2 + 3H2![]() 2NH3 达到平衡状态的标志是
2NH3 达到平衡状态的标志是
A. N2、H2、NH3在容器中共存
B. 混合气体的总物质的量不再发生变化
C. 单位时间内生成n mol N2,同时生成3n mol H2
D. 单位时间内消耗n mol N2,同时消耗n mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是(NA表示阿伏加德罗常数)( )
A.常温c(OH-)/c(H+)=10-13的溶液中可能含有K+、Fe2+、NO3-、Cl-四种离子
B.1 L 0.1molL-1的CH3COONa溶液中CH3COO-和OH-的总数大于0.1NA
C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ +Cu = Fe2++Cu2+
D.H2的燃烧热为a kJ·mol-1,H2燃烧热的热化学方程式为:O2(g) +2H2(g) = 2H2O(l) ΔH = -2a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要的营养物质,又是重要的化工原料。下列叙述与油脂含有的碳碳不饱和键(![]() )有关的是( )
)有关的是( )
A.衣服上的油脂可用汽油洗去
B.适量摄人油脂,有利于人体吸收多种脂溶性维生素和胡萝卜素
C.植物油通过氢化可以制造植物奶油(人造奶油)
D.脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对已达到化学平衡的反应:![]() ;(正反应为放热反应),其他条件不变,则下列说法正确的一组是
;(正反应为放热反应),其他条件不变,则下列说法正确的一组是
①恒温恒容条件下,充入不参与反应的气体He,平衡不移动,各种气体的体积分数不变
②恒温恒压条件下,充入不参与反应的气体He,平衡正向移动,则可知x>3
③恒容条件下,给体系升温,正反应速率和逆反应速率都增大,逆反应速率增大得多些
④恒容条件下,给体系降温,混合气体的平均相对分子质量一定增大
⑤改变某一条件,使平衡正向移动,则反应物A的转化率一定增大
⑥加压压缩容器体积,平衡先逆向移动,后又正向移动,则C或D至少有一种变为非气态
⑦改变某一条件,只要平衡正向移动,则逆反应速率一定减小
A.①③⑤B.②④⑥C.②③⑥D.③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。

(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%

①温度高于230℃,CH3OH产率随温度升高而下降的原因是________。
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作时,下列说法正确的是( )
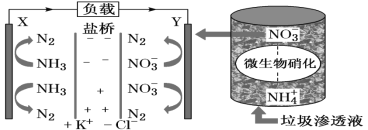
A.盐桥中Cl-向Y极移动
B.Y极发生的反应为2NO3-+10e-+6H2O=N2↑+12OH-,周围pH增大
C.电流由X极沿导线流向Y极
D.电路中流过7.5mol电子时,共产生标准状况下N2的体积为16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaNO3和HCl的混合溶液400mL,向混合溶液中逐渐加入过量的Fe粉,如图所示。(反应中HNO3只被还原成NO)下列说法正确的是
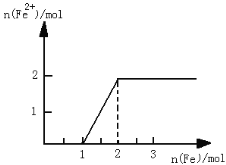
A. 硝酸钠的物质的量浓度为2.5mol/L
B. 标况下,反应过程共产生22.4L的气体
C. 整个反应过程中每步转移的电子之和为4mol
D. 将反应后的混合物过滤,滤液蒸发结晶所得固体为 NaCl和FeCl2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
① 2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
② 4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③ 2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=________kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=________kJ/mol。
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
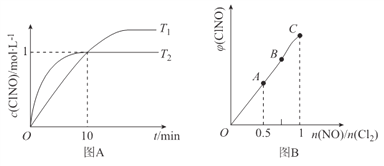
① 由图A可判断T1 ________T2,该反应的△H________0 (填“>”“<”或“=”)。
② 反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min)。
③ T2时该反应的平衡常数K=____________。
(4) 一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com