
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 负极 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
 Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑,金属铝能和酸反应产生氢气,温度、浓度、原电池原理均能使化学反应速率加快,开始阶段产生气体的速率不断加快的原因是其中某一个或多个因素的结果,
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑,金属铝能和酸反应产生氢气,温度、浓度、原电池原理均能使化学反应速率加快,开始阶段产生气体的速率不断加快的原因是其中某一个或多个因素的结果,

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
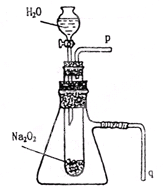 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 负极 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL 0.01mol?L-1KMnO4溶液与2mL 0.1mol?L-1 H2C2O4溶液进行实验,改变条件如下:
Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL 0.01mol?L-1KMnO4溶液与2mL 0.1mol?L-1 H2C2O4溶液进行实验,改变条件如下:| 组别 | 10%硫酸的体积(mL) | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
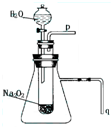 有演示实验:用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
有演示实验:用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:
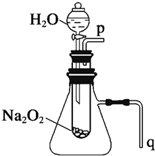 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com