(用NA表示阿伏加德罗常数的值)在 300mL 2mol/L H2SO4 溶液中,溶质的质量是________,此溶液中含 H+ 的物质的量是________,从中取出10mL,H+ 的物质的量浓度是________ 其中含有________个 SO42-,将取出的溶液稀释到100mL,其中SO42-的物质的量浓度是________.
58.8g 1.2mol 4mol/L 0.02N
A 0.2mol/L
分析:根据n=cV计算硫酸的物质的量,再根据m=nM计算硫酸的质量,溶液中H
+的物质的量是硫酸的2倍;
溶液是均匀的,取出的氢离子浓度与原溶液中相等,为硫酸浓度的2倍,根据n=cV计算SO
42-的物质的量,再根据N=nN
A计算SO
42-数目,根据c=

计算稀释后SO
42-的物质的量浓度.
解答:在 300mL2mol/L H
2SO
4 溶液中n(H
2SO
4)=0.3L×2mol/L=0.6mol,m(H
2SO
4)=0.6mol×98g/mol=58.8g,溶液中含 H
+ 的物质的量:n(H
+)=2n(H
2SO
4)=2×0.6mol=1.2,
从中取出10mL,溶液是均匀的,取出的氢离子浓度与原溶液中相等,故c(H
+)=2c(H
2SO
4)=2×2mol/L=4mol/L,
c(SO
42-)=c(H
2SO
4)=2mol/L,故n(SO
42-)=0.01L×2mol/L=0.02mol,所以N(SO
42-)=0.02mol×N
Amol
-1=0.02N
A,将取出的溶液稀释到100mL,其中SO
42-的物质的量浓度为
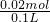
=0.2mol/L,
故答案为:58.8g;1.2mol;4mol/L;0.02N
A;0.2mol/L.
点评:本题考查物质的量浓度及物质的量的计算等,比较基础,注意对公式的理解与灵活运用.

 计算稀释后SO42-的物质的量浓度.
计算稀释后SO42-的物质的量浓度.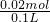 =0.2mol/L,
=0.2mol/L,
