
”¾ĢāÄæ”潫Ćŗ×Ŗ»ÆĪŖĖ®ĆŗĘųµÄÖ÷ŅŖ»Æѧ·“Ó¦ĪŖC£Øs£©+H2O£Øg£©![]() CO£Øg£©+H2£Øg£©£»
CO£Øg£©+H2£Øg£©£»
C£Øs£©”¢CO£Øg£©ŗĶH2£Øg£©ĶźČ«Č¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ
C£Øs£©+O2£Øg£©ØTCO2£Øg£©£»”÷H=©393.5kJmol©1
H2£Øg£©+![]() O2£Øg£©ØTH2O£Øg£©£»”÷H=©242.0kJmol©1
O2£Øg£©ØTH2O£Øg£©£»”÷H=©242.0kJmol©1
CO£Øg£©+![]() O2£Øg£©ØTCO2£Øg£©£»”÷H=©283.0kJmol©1
O2£Øg£©ØTCO2£Øg£©£»”÷H=©283.0kJmol©1
Ēė»Ų“š£ŗ£Ø1£©øł¾ŻŅŌÉĻŹż¾ŻŠ“³öC£Øs£©ÓėĖ®ÕōĘų·“Ó¦µÄČČ»Æѧ·“Ó¦·½³ĢŹ½£ŗ £®
£Ø2£©±Č½Ļ·“Ó¦ČČŹż¾ŻæÉÖŖ£¬1mol CO£Øg£©ŗĶ1mol H2£Øg£©ĶźČ«Č¼ÉշųöµÄČČĮæÖ®ŗĶ±Č1mol C£Øs£©ĶźČ«Č¼ÉշųöµÄČČĮæ¶ą£®¼×Ķ¬Ń§¾Ż“ĖČĻĪŖ”°Ćŗ×Ŗ»ÆĪŖĖ®ĆŗĘųæÉŅŌŹ¹ĆŗČ¼Éշųöøü¶ąµÄČČĮæ”±£»ŅŅĶ¬Ń§øł¾ŻøĒĖ¹¶ØĀÉ×ö³öÓŅĆęŃ»·Ķ¼£ŗ²¢¾Ż“ĖČĻĪŖ”°Ćŗ×Ŗ»ÆĪŖĖ®ĆŗĘųŌŁČ¼ÉշųöµÄČČĮæÓėĆŗÖ±½ÓČ¼ÉշųöµÄČČĮæĻąµČ”±£®Ēė·ÖĪö£ŗ¼×”¢ŅŅĮ½Ķ¬Ń§¹ŪµćÕżČ·µÄŹĒ £ØĢī”°¼×”±»ņ”°ŅŅ”±£©£»ÅŠ¶ĻµÄĄķÓÉŹĒ £®

”¾“š°ø”æ£Ø1£©C£Øs£©+H2O£Øg£©=CO£Øg£©+H2£Øg£©”÷H=+131.5kJ/mol£»
£Ø2£©ŅŅ£»¼×Ķ¬Ń§ŗöĀŌĮĖĆŗ×Ŗ»ÆĪŖĖ®ĆŗĘųŅŖĪüŹÕČČĮ森
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©øł¾ŻøĒĖ¹¶ØĀÉ£ŗ¢ŁC£Øs£©+O2£Øg£©=CO2£Øg£©”÷H=©393.5 kJ/mol£¬
¢ŚCO£Øg£©+![]() O2£Øg£©=CO2£Øg£©”÷H=©283.0 kJ/mol£¬
O2£Øg£©=CO2£Øg£©”÷H=©283.0 kJ/mol£¬
¢ŪCO£Øg£©+![]() O2£Øg£©=CO2£Øg£©”÷H=©283.0 kJ/mol£¬
O2£Øg£©=CO2£Øg£©”÷H=©283.0 kJ/mol£¬
øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł©¢Ś©¢ŪµĆ£»
£Ø2£©øł¾ŻøĒĖ¹¶ØĀÉ£ŗ»Æѧ·“Ó¦²»¹ÜŹĒŅ»²½Ķź³É»¹ŹĒ·Ö¼ø²½Ķź³É£¬Ęä·“Ó¦ČČŹĒĻąĶ¬µÄ£»Ņ²¾ĶŹĒĖµ£¬»Æѧ·“Ó¦µÄ·“Ó¦ČČÖ»Óė·“Ó¦µÄŹ¼Ģ¬ŗĶÖÕĢ¬ÓŠ¹Ų£¬Óė·“Ó¦Ķ¾¾¶ĪŽ¹Ų£®¼“Čē¹ūŅ»øö·“Ó¦æÉŅŌ·Ö¼ø²½½ųŠŠ£¬Ōņø÷²½·“Ó¦µÄ·“Ó¦ČČÖ®ŗĶÓėøĆ·“Ó¦Ņ»²½Ķź³ÉŹ±µÄ·“Ó¦ČČĻąĶ¬£»øł¾ŻĆŗ×Ŗ»ÆĪŖĖ®ĆŗĘųŅŖĪüŹÕČČĮ森
½ā£ŗ£Ø1£©¢ŁC£Øs£©+O2£Øg£©=CO2£Øg£©”÷H=©393.5 kJ/mol£¬
¢ŚCO£Øg£©+![]() O2£Øg£©=CO2£Øg£©”÷H=©283.0 kJ/mol£¬
O2£Øg£©=CO2£Øg£©”÷H=©283.0 kJ/mol£¬
¢ŪCO£Øg£©+![]() O2£Øg£©=CO2£Øg£©”÷H=©283.0 kJ/mol£¬
O2£Øg£©=CO2£Øg£©”÷H=©283.0 kJ/mol£¬
øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł©¢Ś©¢ŪµĆ£ŗC£Øs£©+H2O£Øg£©=CO£Øg£©+H2£Øg£©”÷H=+131.5kJ/mol£¬
¹Ź“š°øĪŖ£ŗC£Øs£©+H2O£Øg£©=CO£Øg£©+H2£Øg£©”÷H=+131.5kJ/mol£»
£Ø2£©»Æѧ·“Ó¦²»¹ÜŹĒŅ»²½Ķź³É»¹ŹĒ·Ö¼ø²½Ķź³É£¬Ęä·“Ó¦ČČŹĒĻąĶ¬µÄ£»Ņ²¾ĶŹĒĖµ£¬»Æѧ·“Ó¦µÄ·“Ó¦ČČÖ»Óė·“Ó¦µÄŹ¼Ģ¬ŗĶÖÕĢ¬ÓŠ¹Ų£¬Óė·“Ó¦Ķ¾¾¶ĪŽ¹Ų£®¼“Čē¹ūŅ»øö·“Ó¦æÉŅŌ·Ö¼ø²½½ųŠŠ£¬Ōņø÷²½·“Ó¦µÄ·“Ó¦ČČÖ®ŗĶÓėøĆ·“Ó¦Ņ»²½Ķź³ÉŹ±µÄ·“Ó¦ČČĻąĶ¬£»Ćŗ×Ŗ»ÆĪŖĖ®ĆŗĘųŅŖĪüŹÕČČĮ棬
¹Ź“š°øĪŖ£ŗŅŅ£»¼×Ķ¬Ń§ŗöĀŌĮĖĆŗ×Ŗ»ÆĪŖĖ®ĆŗĘųŅŖĪüŹÕČČĮ森



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
A£®1.68gFeŗĶ×ćĮæĖ®ÕōĘų·“Ó¦£¬×ŖŅʵĵē×ÓŹżÄæĪŖ0.09NA
B£®ÓÉ31HŗĶ168O×é³ÉµÄ³¬ÖŲĖ®11g£¬ĘäÖŠĖłŗ¬µÄÖŠ×ÓŹżĪŖ6NA
C£®1L1mol”¤L-1µÄNaClOČÜŅŗÖŠŗ¬ÓŠClO-µÄŹżÄæĪŖNA
D£®1mol°×Į×(P4)·Ö×ÓÖŠĖłŗ¬¹²¼Ū¼üŹżĪŖ4NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆѧÓėČĖĄąÉś»ī”¢Éś²śŗĶÉē»įæɳ֊ų·¢Õ¹ĆÜĒŠĻą¹Ų£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
A£®Ė®Äą”¢²£Į§”¢Ēą»Ø“É”¢Ė®¾§”¢Āźč§¶¼ŹōÓŚ¹čĖįŃĪ¹¤Ņµ²śĘ·
B£®Ńõ»ÆĀĮŗĶŃõ»ÆĆ¾¶¼ŹĒµē½āÖŹ£¬¹¤ŅµÉĻæÉÓĆÓŚµē½āÖĘČ”ĀĮŗĶĆ¾
C£®ÓĆ“æ¼īÖĘ²£Į§”¢ÓĆĢśæóŹÆĮ¶Ģś”¢ÓĆ°±ÖĘĢ¼Ėįļ§¶¼»į²śÉśĪĀŹŅĘųĢå
D£®¾²µē³ż³¾”¢Č¼Ćŗ¹ĢĮņ”¢Ęū³µĪ²Ęų“߻ƾ»»Æ¶¼æÉŅŌĢįøßæÕĘųÖŹĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĪŖÖĘČ”“æ¾»øÉŌļµÄCl2²¢ČĆĘäÓėĢś·¢Éś·“Ó¦µÄ×°ÖĆ£¬AŹĒCl2·¢Éś×°ÖĆ£¬C”¢DĪŖĘųĢå¾»»Æ×°ÖĆ£¬EÓ²ÖŹ²£Į§¹Ü֊װӊĻøĢśĖæĶų£»FĪŖøÉŌļµÄæÕ¹ćæŚĘ棻ÉÕ±GĪŖĪ²ĘųĪüŹÕ×°ÖĆ£®ŹŌ»Ų“š£ŗ
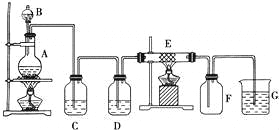
£Ø1£©C”¢GĮ½øö×°ÖĆĖłŹ¢·ÅµÄŹŌ¼Į·Ö±šŹĒ£ŗ C G £®
£Ø2£©¢Ł×°ÖĆ“īŗĆŠė½ųŠŠĘųĆÜŠŌ¼ģ²é£¬Š“³ö²Ł×÷·½·Ø£ŗ £®
¢ŚĮ½“¦¾Ę¾«µĘÓ¦ĻȵćČ¼ “¦£ØĢīŠ“A»ņB£©£¬ÄæµÄŹĒ £®
¢ŪFÖŠµÄĻÖĻóĪŖ £¬GÖŠ³öĻÖĮĖŅ»ÖÖ³Įµķ£¬øĆ³ĮµķµÄ»ÆѧŹ½ £®
£Ø3£©Š“³öŌŚA”¢EÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
A£ŗ £®
E£ŗ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆѧÓėČĖĄąÉś²ś”¢Éś»īĆÜĒŠĻą¹Ų£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ¼õÉŁSO2µÄÅÅ·Å£¬æÉŅŌ“Óøł±¾ÉĻĻū³żĪķö²
B. ¹čĖį¶ąæ×”¢ĪüĖ®ÄÜĮ¦Ē棬³£ÓĆ×÷“ü×°Ź³Ę·µÄøÉŌļ
C. ĀĢÉ«»ÆѧµÄŗĖŠÄŹĒĄūÓĆ»ÆѧŌĄķ¶Ō»·¾³ĪŪČ¾½ųŠŠÖĪĄķ
D. Ņ½ÓĆĻū¶¾¾Ę¾«ÖŠŅŅ“¼µÄÅضČĪŖ95%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµēø”єĿ¾Ū·ØŹĒ¹¤ŅµÉĻ²ÉÓƵÄŅ»ÖÖĪŪĖ®“¦Ąķ·½·Ø£ŗ±£³ÖĪŪĖ®µÄpHŌŚ5£®0”«6£®0Ö®¼ä£¬Ķعżµē½āÉś³ÉFe£ØOH£©3³Įµķ”£Fe£ØOH£©3ÓŠĪüø½ŠŌ£¬æÉĪüø½ĪŪĪļ¶ų³Į»żĻĀĄ“£¬¾ßÓŠ¾»»ÆĖ®µÄ×÷ÓĆ”£Ņõ¼«²śÉśµÄĘųÅŻ°ŃĪŪĖ®ÖŠŠüø”Īļ“ųµ½Ė®ĆęŠĪ³Éø”Ōü²ć£¬¹ĪČ„£Ø»ņĘ²µō£©ø”Ōü²ć£¬¼“Ęšµ½ĮĖø”Ń”¾»»ÆµÄ×÷ÓĆ”£Ä³æĘŃŠŠ”×éÓƵēø”єĿ¾Ū·Ø“¦ĄķĪŪĖ®£¬Éč¼Ę×°ÖĆČēĶ¼ĖłŹ¾£ŗ

£Ø1£©ŹµŃ鏱ČōĪŪĖ®ÖŠĄė×ÓÅØ¶Č½ĻŠ”£¬µ¼µēÄÜĮ¦½Ļ²ī£¬²śÉśĘųÅŻĖŁĀŹ»ŗĀż£¬ĪŽ·ØŹ¹Šüø”ĪļŠĪ³Éø”Ōü”£“Ė Ź±£¬Ó¦ĻņĪŪĖ®ÖŠ¼ÓČėŹŹĮæµÄ ”£
a£®H2SO4 b£®BaSO4 c£®Na2SO4 d£®NaOH
£Ø2£©µē½ā³ŲŃō¼«µÄµē¼«·“Ó¦·Ö±šŹĒ¢Ł £»¢Ś4OH££4e£=2H2O£«O2”ü”£
£Ø3£©µē¼«·“Ó¦¢ŁŗĶ¢ŚµÄÉś³ÉĪļ·“Ó¦µĆµ½Fe(OH)3³ĮµķµÄĄė×Ó·½³ĢŹ½ŹĒ ”£
£Ø4£©ČŪČŚŃĪČ¼ĮĻµē³ŲŹĒŅŌČŪČŚĢ¼ĖįŃĪĪŖµē½āÖŹ£¬ŅŌCH4ĪŖČ¼ĮĻ£¬æÕĘųĪŖŃõ»Æ¼Į£¬Ļ”ĶĮ½šŹō²ÄĮĻĪŖµē¼«”£
¢ŁŅŃÖŖøŗ¼«µÄµē¼«·“Ó¦ŹĒCH4+4CO32-- 8e£=5CO2+2H2O”£Õż¼«µÄµē¼«·“Ó¦ŹĒ ”£
¢ŚĪŖĮĖŹ¹øĆČ¼ĮĻµē³Ų³¤Ź±¼äĪȶØŌĖŠŠ£¬µē³ŲµÄµē½āÖŹ×é³ÉÓ¦±£³ÖĪČ¶Ø”£ĪŖ“Ėµē³Ų¹¤×÷Ź±±ŲŠėÓŠ²æ·ÖAĪļÖŹ²Ī¼ÓŃ»·”£ŌņAĪļÖŹµÄ»ÆѧŹ½ŹĒ ”£
£Ø5£©ŹµŃé¹ż³ĢÖŠ£¬ČōŌŚŅõ¼«²śÉśĮĖ44£®8 L£Ø±ź×¼×“æö£©ĘųĢ壬ŌņČŪČŚŃĪČ¼ĮĻµē³ŲĻūŗÄCH4£Ø±ź×¼×“æö£© L”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶Ø¹Ģ¶ØČŻ»żµÄĆܱÕČŻĘ÷ÖŠ£¬CO2£Øg£©ÓėŅ»¶ØĮæµÄC£Øs£©·¢Éś½ųŠŠČēĻĀ»Æѧ·“Ó¦£ŗCO2£Øg£©+C£Øs£©2CO£Øg£©£®
¢ŁøĆ·“Ó¦ĪŖ ·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©£®
¢ŚøĆ·“Ó¦µÄ·“Ó¦ĖŁĀŹĖꏱ¼äµÄ±ä»ÆĶ¼ĻóČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ £ØĢīŠņŗÅ£©£®
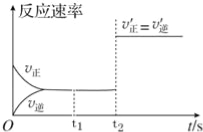
a£®t1Ź±æĢøĆ·“Ó¦ŅŃ¾“¦ÓŚ»ÆŃ§Ę½ŗāדĢ¬
b£®t2Ź±æĢc£ØCO2£©=c£ØCO£©
c£®t2Ź±æĢøĆ·“Ó¦ČŌČ»“¦ÓŚ»ÆŃ§Ę½ŗāדĢ¬
d£®t2Ź±æĢ£¬øıäµÄĢõ¼žæÉÄÜŹĒŌö“óĮĖCµÄĪļÖŹµÄĮ森
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½«ÖŹĮæĪŖ12.64g KMnO4¹ĢĢå¼ÓČČŅ»¶ĪŹ±¼äŗó£¬ŹÕ¼Æµ½amolO2£»Ļņ·“Ó¦ŗó²ŠĮōµÄ¹ĢĢåÖŠ¼ÓČė×ćĮæµÄÅØŃĪĖį£¬ÓÖŹÕ¼Æµ½bmolCl2£¬“ĖŹ±MnŌŖĖŲČ«²æŅŌMn2+µÄŠĪŹ½“ęŌŚÓŚČÜŅŗÖŠ”£
£Ø1£©ĒėĶź³É²¢ÅäĘ½ĻĀĮŠ»Æѧ·½³ĢŹ½£ŗ
K2MnO4+ HCl £ KCl+ MnCl2+ Cl2”ü+![]()
£Ø2£©ÓĆĖįŠŌøßĆĢĖį¼ŲČÜŅŗµĪ¶ØFeSO4ČÜŅŗŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½______________”£
£Ø3£©µ±KMnO4¹ĢĢå¼ÓČČÉś³ÉO2 a molÖµ×ī“óŹ±£¬Ļņ·“Ó¦ŗó²ŠĮōµÄ¹ĢĢåÖŠ¼ÓČė×ćĮæµÄÅØŃĪĖį²¢¼ÓČČ£¬²śÉśCl2µÄĪļÖŹµÄĮæb= mol”£(“ĖŹ±MnŌŖĖŲČ«²æŅŌMn2+µÄŠĪŹ½“ęŌŚÓŚČÜŅŗÖŠ)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNA±ķŹ¾°¢·üŁ¤µĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
A£®16g CH4Ėłŗ¬Ō×ÓŹżÄæĪŖNA
B£®1mol”¤L£1 NaClČÜŅŗŗ¬ÓŠNAøöNa+
C£®³£ĪĀ³£Ń¹ĻĀ£¬22.4L CO2ÖŠŗ¬ÓŠNAøöCO2·Ö×Ó
D£®2.4g MgÓė×ćĮæŃĪĖį·“Ó¦×ŖŅʵĵē×ÓŹżĪŖ0.2NA
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com