
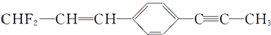
 分子结构的下列叙述中,正确的是( )
分子结构的下列叙述中,正确的是( )| A、除苯环外的其余碳原子有可能都在一条直线上 |
| B、所有的原子都在同一平面上 |
| C、12个碳原子不可能都在同一平面上 |
| D、12个碳原子有可能都在同一平面上 |
 分子中,甲基中C原子处于苯中H原子的位置,甲基通过旋转碳碳单键会有1个H原子处在苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子(苯环上6个、甲基中2个、碳碳双键上2个、碳碳三键上2个)共面,故C错误;
分子中,甲基中C原子处于苯中H原子的位置,甲基通过旋转碳碳单键会有1个H原子处在苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子(苯环上6个、甲基中2个、碳碳双键上2个、碳碳三键上2个)共面,故C错误; 分子中,甲基中C原子处于苯中H原子的位置,甲基通过旋转碳碳单键会有1个H原子处在苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子(苯环上6个、甲基中2个、碳碳双键上2个、碳碳三键上2个)共面,故D正确.
分子中,甲基中C原子处于苯中H原子的位置,甲基通过旋转碳碳单键会有1个H原子处在苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子(苯环上6个、甲基中2个、碳碳双键上2个、碳碳三键上2个)共面,故D正确.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
| A、三者对应的氧化物均为酸性氧化物 |
| B、实验室可用NaOH溶液处理NO2和HCl废气 |
| C、三者的单质直接与氧气反应都能生成两种氧化物 |
| D、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | Na2SO4、KCl、K2CO3、NaCl |
| 第三次 | KCl、BaCl2、Na2SO4、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸保存在无色玻璃瓶中 |
| B、少量金属钠可保存在煤油里 |
| C、新制氯水保存在棕色试剂瓶中 |
| D、少量液溴可加水水封,并放置于阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量氢氧化钠溶液和硫酸铝溶液 |
| B、氢氧化钠溶液和过量碳酸氢钠溶液 |
| C、少量铜粉和氯化铁溶液 |
| D、过氧化钠和少量氯化亚铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据化学反应中的热效应将化学反应分为放热反应和吸热反应 |
| B、根据水溶液能否导电将化合物分为电解质和非电解质 |
| C、根据氧化物的组成将氧化物分为酸性氧化物、碱性氧化物和两性氧化物 |
| D、根据分散质和分散剂的聚集状态将分散系为浊液、胶体和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com