
| A. | 0.37 | B. | 0.24 | C. | 0.16 | D. | 无法确定 |
分析 甲醛、乙醛、丙酸(C3H6O2)、丁烯、环氧乙烷(C2H4O)的混合物中,C、H原子数目之比为定值1:2,故C、H元素质量之比为6:1,结合H元素质量分数计算混合物中C元素质量分数,进而计算混合物中氧元素质量分数.
解答 解:甲醛、乙醛、丙酸(C3H6O2)、丁烯、环氧乙烷(C2H4O)的混合物中,C、H原子数目之比为定值1:2,故C、H元素质量之比为12:2=6:1,混合物中H元素质量分数为9%,则混合物中H元素质量分数=9%×6=54%,故混合物中氧元素质量分数为1-9%-54%=37%,
故选A.
点评 本题考查混合物中元素质量分数计算,难度中等,根据化学式确定混合物中C、H元素质量之比是关键.


科目:高中化学 来源: 题型:选择题
| A. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| B. | 家用天然气含有特殊气味的主要原因是开采的天然气未经处理就直接转为民用燃气 | |
| C. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Y- | |
| C. | 同族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
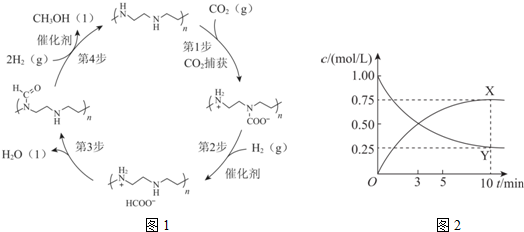
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
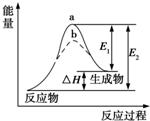
| A. | 该反应为吸热反应,△H=E1-E2 | |
| B. | 使用催化剂,△H减小 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 如图可知b使用了催化剂,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将电石与水反应产生的气体通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成 | |
| B. | 将溴乙烷与NaOH的乙醇溶液共热产生的气体通入溴水中,溶液褪色说明有乙烯生成 | |
| C. | 向稀氨水中滴加硝酸银溶液配得银氨溶液 | |
| D. | 溴乙烷与氢氧化钠溶液共热后,加入硝酸银溶液检验Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液的pH=7 | |
| B. | 把镁粉加入FeCl3饱和溶液中,有气体和红褐色沉淀生成 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液蒸干的方法 | |
| D. | 盐类水解反应的逆反应是酸碱中和反应,但酸碱中和反应不一定是可逆反应. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com