

(1)a点之前反应的方程式为__________________________。
(2)c点的二氧化碳体积是____________mL。
(3)混合稀溶液中Ca(OH)2和NaOH的物质的量之比为________________。
(1)Ca2++2OH-+CO2====CaCO3↓+H2O
(2)90
(3)1∶1
解析:此题是与图象结合的计算题,解答此类题目首先要看懂图象,包括纵轴横轴的意义,图象中的起点、拐点、终点等。分析此题图轴可知图象表示的是生成的沉淀随通入的CO2体积的变化。结合图象变化可知:Oa段沉淀量逐渐增大,ab段沉淀量不变,bc段沉淀量逐渐减少最终消失。结合题干可知各段发生的反应分别是:
Oa段:Ca(OH)2+CO2====CaCO3↓+H2O
ab段:NaOH+CO2====NaHCO3
bc段:CaCO3+CO2+H2O====Ca(HCO3)2
则a点之前反应的离子方程式为:Ca2++2OH-+CO2====CaCO3↓+H2O
结合Oa段和bc段化学方程式可知:
CO2 ~ CaCO3 ~ CO2
1 1 1
30 mL 30 mL
即:bc段消耗的CO2的体积为30 mL,c点的二氧化碳体积是90 mL。
由图象可知Oa段和ab段消耗的二氧化碳体积相等,结合Oa段和ab段的化学方程式可知,混合稀溶液中Ca(OH)2和NaOH的物质的量相等,即混合稀溶液中Ca(OH)2和NaOH的物质的量之比是1∶1。


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:038
向Ca(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
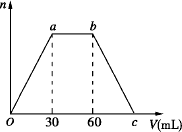
(1)a点之前反应的离子方程式为________;
(2)c点的二氧化碳体积是________mL;
(3)混合稀溶液中Ca(OH)2和NaOH的物质的量之比为________.
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)原混合溶液中KOH的物质的量浓度为_____________mol/mL,250mL溶液中含Ca(OH)2的质量为_________g。
(2)写出A—B这段所发生的反应的离子方程式:_____________________________________
(3)图中V2为_________mL,V3为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
 向Ca(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ca(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
⑴a点之前反应的离子方程式为
;
⑵c点的二氧化碳体积是 mL;
⑶混合稀溶液中Ca(OH)2和NaOH的物质的量之比
为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:填空题
用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
(1)Fe2O3与H2SO4反应的离子方程式是___________。
(2)步骤I中过滤得到的滤渣成分是________(填化学式)。
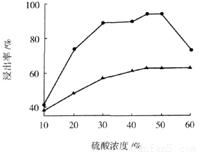
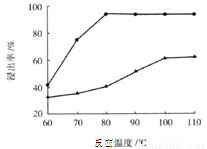
(3)步骤I 中H2SO4的浓度与反应温度会影响铁与铝的浸出率。根据下图分析,步骤I 中H2SO4浓度的适宜范围是__________,反应的适宜温度是_________。

(4)步骤II中增大n(Fe3+)的离子方程式是_________。
(5)步骤III得到碱式硫酸铝铁[AlFe(OH)n(SO4)m]的溶液,则步骤II中应增大n(Fe3+)到
n(Al3+)﹕n(Fe3+)= 。
(6)研究表明,液体聚合硫酸铝铁的纯度越高,净水效果越好。已知:
一些物质在20℃时的溶解度
|
物质 |
Ca(OH)2 |
CaSO4 |
Na2SO4 |
|
溶解度/g |
0.153 |
0.258 |
19.5 |
结合表中数据,解释步骤III中使用Ca(OH)2而不用NaOH的原因__________。
(7)铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com