
分析 (1)小苏打与烧碱溶液反应生成碳酸钠和水;
(2)过量的二氧化碳通入氢氧化钠溶液,反应生成碳酸氢钠;
(3)Na2CO3溶液与CH3COOH溶液反应 生成醋酸钠和二氧化碳、水;
(4)大理石(CaCO3)与稀HNO3反应 生成硝酸钙、二氧化碳和水;
(5)AgNO3溶液和NaCl溶液反应生成氯化银和硝酸钠;
(6)NaOH溶液和H2SO4溶液反应生成硫酸钠和水;
(7)Ba(OH)2溶液和H2SO4溶液,反应生成硫酸钡和水;
解答 解:(1)小苏打与烧碱溶液反应生成碳酸钠和水,离子方程式:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(2)过量的二氧化碳通入氢氧化钠溶液,反应生成碳酸氢钠,离子方程式:CO2+OH-=HCO3-;
故答案为:CO2+OH-=HCO3-;
(3)Na2CO3溶液与CH3COOH溶液反应,反应生成醋酸钠和二氧化碳、水,离子方程式CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O;
故答案为:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O;
(4)大理石(CaCO3)与稀HNO3反应 生成硝酸钙、二氧化碳和水,离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(5)AgNO3溶液和NaCl溶液反应生成氯化银和硝酸钠;离子方程式:Ag++Cl-=AgCl↓;
故答案为:Ag++Cl-=AgCl↓;
(6)NaOH溶液和H2SO4溶液反应生成硫酸钠和水,离子方程式:H++OH-=H2O;
故答案为:H++OH-=H2O;
(7)Ba(OH)2溶液和H2SO4溶液,反应生成硫酸钡和水,离子方程式:Ba2++2H++20H-+SO42-=BaSO4↓+2H2O;
故答案为:Ba2++2H++20H-+SO42-=BaSO4↓+2H2O.
点评 本题考查了离子方程式的书写,明确物质的性质及发生的反应,熟悉离子方程式书写注意问题是解题关键,注意化学式拆分,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 活性炭 | NO | N2 | X | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| A. | 气体X的化学式为CO2 | |
| B. | T1℃时的平衡常数K1=$\frac{9}{32}$ | |
| C. | 根据上述信息判断,T1>T2 | |
| D. | T1℃时,向平衡体系中继续加入活性炭,可提高NO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
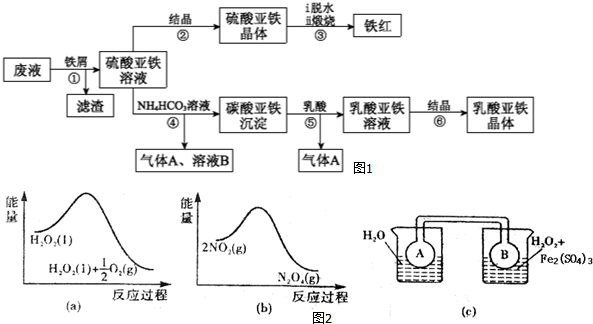
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
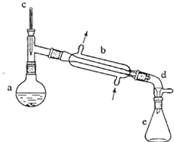 (醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
(醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: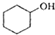 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$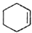 +H2O
+H2O| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①要吸收热量,故反应②更实用些 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,共16纵行 | |
| B. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| C. | Li是最活泼金属,F是最活泼非金属 | |
| D. | NaOH碱性比KOH强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
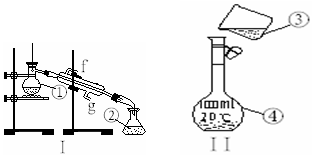 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,增大该体系的压强,平衡正向移动,则C为气体 | |
| B. | 其他条件不变.若升高温度.B的平衡转化率增大.则该反应是放热反应 | |
| C. | 该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| D. | 此时.B的平衡转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
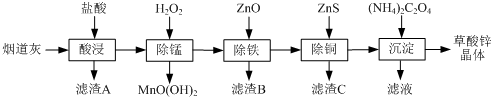
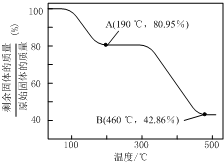
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com