
����Ŀ��ij�¶��£���һ��2 L���ܱ������У�����4 mol A��2 mol B�������·�Ӧ��3A(g)+2B(g)![]() 4C(?)+2D(?)����Ӧһ��ʱ���ﵽƽ�⣬�������1��6 mol C���ҷ�Ӧ��ǰ��ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)��������˵����ȷ����( )
4C(?)+2D(?)����Ӧһ��ʱ���ﵽƽ�⣬�������1��6 mol C���ҷ�Ӧ��ǰ��ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)��������˵����ȷ����( )
A. �÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��![]()
B. ��ʱ��B��ƽ��ת������35��
C. �������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D. ����C��B��ƽ��ת���ʲ���
���𰸡�D
��������A��ƽ��ʱ����1.6molC������ݷ���ʽ��֪ƽ��ʱA��B��C��D�����ʵ����ֱ���2.8mol��1.2mol��1.6mol��0.8mol������ݷ�Ӧ��ǰ��ѹǿ֮��Ϊ5:4��֪��D�����壬C�������壬���÷�Ӧ�������С�Ŀ��淴Ӧ�����ѡ��A����ȷ��B��ƽ��ʱ����1.6molCʱ�������ĵ�B�����ʵ���Ϊ0.8mol����B��ƽ��ת����Ϊ![]() ��100%=40%��ѡ��B����C������Ӧ�������С�ķ�Ӧ�����������ϵ��ѹǿ��ƽ�������ƶ����������¶Ȳ��䣬��ѧƽ�ⳣ�����䣬ѡ��C����D������C�������壬����C������ƽ��ûӰ�죬B��ƽ��ת���ʲ��䣬ѡ��D��ȷ����ѡD��
��100%=40%��ѡ��B����C������Ӧ�������С�ķ�Ӧ�����������ϵ��ѹǿ��ƽ�������ƶ����������¶Ȳ��䣬��ѧƽ�ⳣ�����䣬ѡ��C����D������C�������壬����C������ƽ��ûӰ�죬B��ƽ��ת���ʲ��䣬ѡ��D��ȷ����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������NH4Al(SO4)2����NH4HSO4����NH4Cl����NH3H2O����CH3COONH4�� �ش��������⡣
��1��NH4HSO4 �ĵ��뷽��ʽΪ_____
��2����Ũ�ȵ��ڢܢ�������Һ����NH4+Ũ���ɴ�С��˳����__________��������ű�ʾ��
��3������ʱ��pH=3 �� NH4Cl ��Һ�У�c(C1��)��c(NH4+�� ��_________mol��L��1 ������ֵ��
��4��NH4Al(SO4)2������ˮ������������___________________________________�ñ�Ҫ�Ļ�ѧ������������˵��)
��5����Ũ�Ⱦ�Ϊ 0.1 mol��L��1 ����������Һ��ϣ�����������Һ����˵���������_____
A������Һ�����ԣ��� c(C1��)��c(NH4+ )��c(H+ )��c(OH- )
B���� c(C1��)��c(NH4+)������Һ������
C�����������������ϣ���������Һ�����ϵ��c(NH4+)+c(NH3H2O)��0.2mol��L��1
D.��Ũ�ȴ�С������Ϊ��c��C1����>c��NH4+��>c��OH����>c��H+��
��6����֪ CH3COONH4 ��ҺΪ���ԣ����ƶ�(NH4)2CO3 ��Һ�� pH________7 (����������������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���ɷǽ���Ԫ�ز������γ����ӻ�����
B.���ɷ��ӵ�����һ�����й��ۼ�
C.���ӻ������п��ܺ��й��ۼ�
D.�����л�ѧ�����ѹ���һ�������˻�ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ������(�ס��ҡ��������е���������)�����պϸ�װ�õĵ��Kʱ���۲쵽��������ָ�뷢����ƫת��

��ش���������:
(1)�׳�Ϊ_________(�ԭ��ء��������ء���Ƴء�)��A�缫�ĵ缫��ӦʽΪ______��
(2)������F�缫Ϊ____(�����������������������������������)���ó��ܷ�Ӧ�ķ���ʽΪ_____��
(3)���ҳ���C����������4.32gʱ���׳���B�缫����������O2�����Ϊ_____mL(��״��)��
(4)һ��ʱ��Ͽ����K������������ʹ�ҳػָ�����ӦǰŨ�ȵ���______(����ĸ)��
A.Cu B.CuO C.Cu(OH)2 D.Cu(OH)2CO3
(5)�״����Ҵ���������ȼ�ϡ���֪�Ҵ�Һ����ȫȼ������CO2�����1molҺ̬ˮʱ�ų�����453.3kJ����д���Ҵ�ȼ�յ��Ȼ�ѧ����ʽ:____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����CO�����״��ķ�ӦΪCO(g)+2H2(g)CH3OH(g) ��H=akJ/mol.ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£�������̶�Ϊ1L���ܱ������м���2molH2��һ������CO(g)��CO(g)��CH3OH(g)��Ũ����ʱ��ı仯ͼ..���������������( )
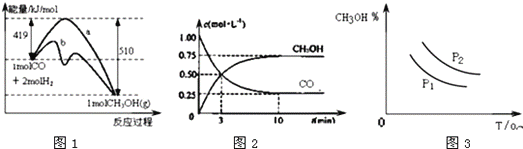
A. CO��H2�ϳ�CH3OH�ķ�Ӧ����H<0����S<0
B. �����¶Ȳ��䣬�ٳ���1molCO��2molH2����Ӧ�ﵽ��ƽ��ʱn(CH3OH)/n(CO)��С
C. ͼ1������b�ɱ�ʾʹ���˴����������仯���
D. ͼ3�����߿ɱ�ʾ�ڲ�ͬѹǿP1.P2(P1<P2)�����¼״��ٷֺ������¶ȱ仯�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������أ�����Ӧ�������������������Ե��ǣ� ��
A.��������ˮ
B.�ú�ϡ�ĸ��������Һ����
C.ʳ�׳�ˮ��
D.��������Ư�ײ�ñ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijЩ���ӵļ��鼰����һ����ȷ����
A. ����ϡ���������ɫ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ�һ����CO![]()
B. �����Ȼ�����Һ�а�ɫ�����������ټ����ᣬ��������ʧ��һ����SO![]()
C. ��������������Һ�����ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ������һ����NH![]()
D. ����̼������Һ������ɫ�������ټ������ɫ������ʧ��һ����Ba2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ����������������( )
A.N2��һ����ɫ��ζ������B.N2�������������ʺ������ԭ��
C.N2����Ũ����ͼ�ʯ�Ҹ���D.N2�����ſ������ռ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҩҩ����˪����Ҫ�ɷ�ΪAs2O3������ˮ�������������Ƽ���Ѫ������ҵ���ú����飨As2S3)�ķ���������˪�Ĺ���������ͼ��ʾ��
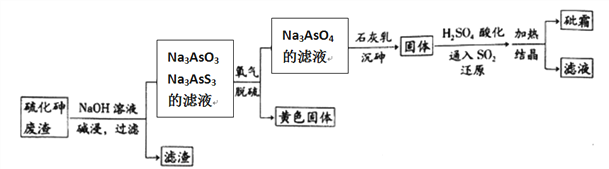
��1����������Ԫ�ػ��ϼ�Ϊ__________����������ˮ�����������������Ԫ�ؼ�̬���䣬��������Ҫ��Ӧ�����ӷ���ʽΪ________________________��
��2��������������б�������Ԫ����____________��
��3����ԭ������H3AsO4ת��ΪH3AsO3����Ӧ�Ļ�ѧ����ʽ��____________________��
��4��������������һ���¶��½���Ԫ��ת��ΪCa5(AsO4)3OH�����Ĺ��̣���Ҫ��Ӧ�У�
a.Ca(OH)2(S)![]() Ca2+(aq) +2OH-(aq) Ksp=10-7
Ca2+(aq) +2OH-(aq) Ksp=10-7
b.Ca5(AsO4)3OH (S)![]() 5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
����ʯ�������Һ��c(OH-) =0.01mol L-1����ʱ��Һ��c(AsO43-) =________________��(��֪�� ![]() =2. 15)
=2. 15)
��5����ԭ�������Һ��H3AsO3�ֽ�ΪAs2O3���ᾧ�õ���As2O3��As2O3�ڲ�ͬ�¶ȺͲ�ͬŨ�������е��ܽ�ȶ�(S)��������ͼ��ʾ��
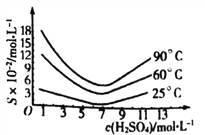
Ϊ����ߴ�As2O3�ij����ʣ����ᾧ�����̽��еIJ���������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ��ڴ˹�����Ӧ���Ƶ�����Ϊ_________________��
��6���ڹ�ҵ�����У����һ��������Һ��ѭ��ʹ�ã���Ŀ����____________________��
��7����Ԫ�ع㷺��������Ȼ�磬�����仯���ﱻ������ũҩ�����ݼ���ɱ����ȡ�
����ij�����������As2O3��As2O5������As2O5���ȶ��Բ����ͼ1д��As2O5�ֽ�ΪAs2O3���Ȼ�ѧ����ʽ___________________________________________��
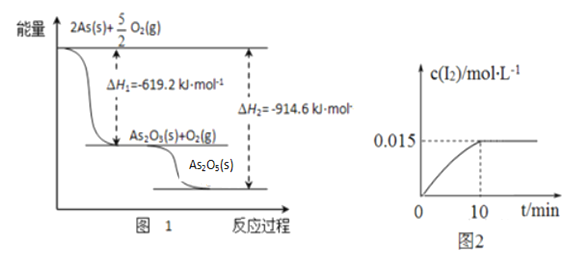
�������ƾ��������ԣ�298 Kʱ����100 mL�ձ��м���10 mL 0.1 mol/L Na3AsO4��Һ��20 mL 0.1 mol/L KI��Һ��20 mL 0.05 mol/L������Һ���������з�Ӧ��AsO43-(��ɫ)+2I-+2H+![]() AsO33-(��ɫ)+I2(dz��ɫ)+H2O �������Һ��c(I2)��ʱ��(t)�Ĺ�ϵ��ͼ2��ʾ����Һ����仯���Բ��ƣ���������������������淴Ӧ�ﵽƽ��״̬����_______������ĸ���ţ���
AsO33-(��ɫ)+I2(dz��ɫ)+H2O �������Һ��c(I2)��ʱ��(t)�Ĺ�ϵ��ͼ2��ʾ����Һ����仯���Բ��ƣ���������������������淴Ӧ�ﵽƽ��״̬����_______������ĸ���ţ���
a����Һ��ɫ���ֲ��ٱ仯 b��c(AsO33-)+c(AsO43-)���ٱ仯
c��AsO43-���������ʵ���I2���������� d�� ![]() ���ֲ��ٱ仯
���ֲ��ٱ仯
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com