
| A. | CaO | B. | CaCl2 | C. | NaOH | D. | C2H6 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磺化、硝化、水化、风化、钝化等都是化学变化 | |
| B. | 干馏、常压分馏、减压分馏都是物理变化 | |
| C. | 甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰 | |
| D. | 水煤气、裂解气、焦炉气、天然气都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
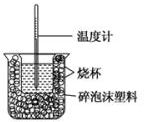 已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备肥皂,利用花生油与稀硫酸混合液在小烧杯中加热,直到油滴消失 | |
| B. | 配置菲林试剂,在硫酸铜溶液中加入少量的氢氧化钠溶液 | |
| C. | 检验卤代烃消去反应的有机产物:1-溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别汽油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
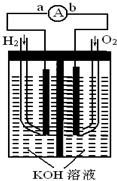 燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.
燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;KCl第电子式
;KCl第电子式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com