
空气 吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
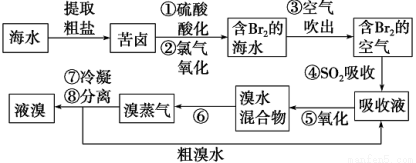
(1)步骤①中用硫酸酸化的目的是 ;
步骤②发生反应的离子方程式为 。
(2)步骤④利用了SO2的还原性,反应的离子方程式: 。
(3)步骤⑥的名称是 。
(4)从含Br2的海水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是3Na2CO3+3Br2==NaBrO3+5NaBr+3CO2;吸收1 mol Br2时,转移的电子为_________mol。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ae | B. | aef | C. | abc | D. | ac |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2 | |
| B. | 4.6gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| C. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| D. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
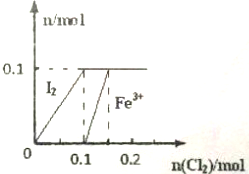 某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中c (Na+)与c (CO32-)之比 | |
| B. | 0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的盐酸中c (H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c (NH4+)与c (SO42-)之比 | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应一定有氧元素参加 | |
| B. | 氧化还原反应的本质是电子的转移 | |
| C. | 物质中某元素失去电子,则此物质是氧化剂 | |
| D. | 某一反应中有元素化合价的变化,则该反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③④ | C. | ①②③ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:实验题
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为__ 。
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是 。
(3)丙组同学取10mL 0.1mol/L KI溶液,加入6mL 0.1mol/L FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有 (填离子符号) ,由此可以证明该氧化还原反应为 反应(填“可逆”或“不可逆”)。
,由此可以证明该氧化还原反应为 反应(填“可逆”或“不可逆”)。
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 ;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是 ;生成沉淀的原因是 (用平衡移动原理解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com