


科目:高中化学 来源: 题型:
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A、甲的金属性比乙弱 |
| B、乙的化合价为+1价 |
| C、丙一定为非金属元素 |
| D、丁一定为金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式查看答案和解析>>
科目:高中化学 来源: 题型:
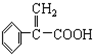
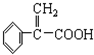 )及高聚物F.
)及高聚物F.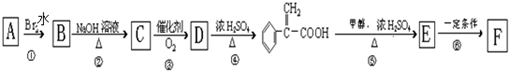
 具有相同官能团且属于芳香族化合物的同分异构体有
具有相同官能团且属于芳香族化合物的同分异构体有 的任意一个同分异构体的结构简式
的任意一个同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )
如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )| A、向NaAlO2溶液中逐渐滴入HCl至过量 |
| B、向澄清石灰水中通入SO2至过量 |
| C、向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D、向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验CO2与Na2O2反应有O2生成,可将CO2气体依次通过Na2O2和浓NaOH溶液,然后收集并用带火星的木条验证 |
| B、除CO2中混有的少量SO2,可依次通过盛有酸性KMnO4溶液、品红溶液的洗气瓶,得纯净CO2 |
| C、检验Fe3O4中混有Fe2O3,可将混合物加入足量稀硫酸溶液,然后取样加入KSCN溶液 |
| D、检验Cl2中混有SO2,可将混合气体通入品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com