


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.04 | 0.25 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
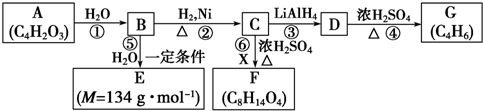
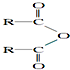
| H2O |
| LiAlH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、Cl-、CO32- |
| B、Mg2+、NH4+、Cl-、NO3- |
| C、CH3COO-、SO42-、Ba2+、K+ |
| D、Fe2+、Cl-、NO3-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水加热到很高的温度都难以分解 |
| B、水结成冰体积膨胀,密度变小 |
| C、CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D、HCl的稳定性强于HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
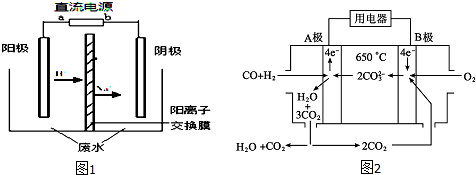
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com