

 ,A的结构简式为:
,A的结构简式为: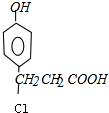 ,A和碳酸氢钠反应生成C,C的结构简式为:
,A和碳酸氢钠反应生成C,C的结构简式为: ;
;| 2×4+2-10 |
| 2 |
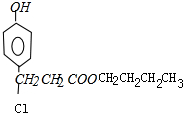 .
. ,A的结构简式为:
,A的结构简式为: ,A和碳酸氢钠反应生成C,C的结构简式为:
,A和碳酸氢钠反应生成C,C的结构简式为: ;
;| 2×4+2-10 |
| 2 |
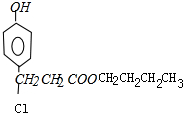 .
. ,则A中含有的含氧官能团是羧基和酚羟基,故答案为:(酚)羟基、羧基;
,则A中含有的含氧官能团是羧基和酚羟基,故答案为:(酚)羟基、羧基;| Cu |
| △ |
| Cu |
| △ |
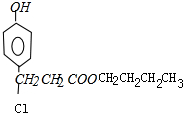 ,
,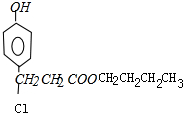 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 某有机物结构简式如图所示,1mol该有机物分别与Na、NaOH、NaHCO3、Na2CO3分别反应最多消耗各物质的物质的量依次是( )
某有机物结构简式如图所示,1mol该有机物分别与Na、NaOH、NaHCO3、Na2CO3分别反应最多消耗各物质的物质的量依次是( )| A、2 2 1 2 |
| B、3 1 1 1.5 |
| C、3 2 1 2 |
| D、2 1 2 1.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Fe2+、K+、Cl-、NO3- |
| B、无色透明的溶液中:MnO4-、SO42-、Na+、H+ |
| C、使石蕊试液变蓝色的溶液中:K+、Cl-、SO32-、SiO32- |
| D、加入铝粉能产生氢气的溶液中:NH4+、SO42-、Cu2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个标准大气压,20℃下11.2L N2含有的分子数为0.5NA |
| B、9g水与标准状况下11.2L氮气含有相同的分子数 |
| C、2.4g金属镁变成镁离子时失去的电子数为0.1NA |
| D、标准状况下,11.2L乙酸所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | 4.7 | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com