
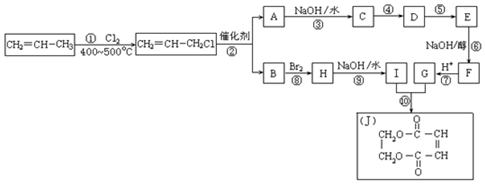
 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.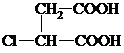 .
.分析 丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,由反应信息可知,CH2=CHCH2Cl在催化剂条件下发生复分解反应生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应生成C,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2.B与溴发生加成反应生成H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I为HOCH2-CH2OH.A在氢氧化钠水溶液、加热条件下发生反应生成C为HOCH2CH=CHCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,由转化关系可知,结合反应④是C与HCl加成生成D,保护C=C不被氧化,D再氧化可得E,故D为HOCH2CH2CHClCH2OH,E为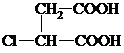
解答 解:丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,由反应信息可知,CH2=CHCH2Cl在催化剂条件下发生复分解反应生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应生成C,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2.B与溴发生加成反应生成H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I为HOCH2-CH2OH.A在氢氧化钠水溶液、加热条件下发生反应生成C为HOCH2CH=CHCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,由转化关系可知,结合反应④是C与HCl加成生成D,保护C=C不被氧化,D再氧化可得E,故D为HOCH2CH2CHClCH2OH,E为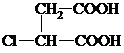
(1)反应①为丙烯的取代反应,所以反应类型是取代反应,故答案为:取代反应;
(2)反应④是与HCl加成,设计这一步反应的目的是保护分子中碳碳双键不被氧化,
故答案为:保护分子中碳碳双键不被氧化;
(3)该反应方程式为2CH2═CH-CH2Cl$\stackrel{催化剂}{→}$ClCH2-CH═CH-CH2Cl+CH2═CH,
故答案为:2CH2═CH-CH2Cl$\stackrel{催化剂}{→}$ClCH2-CH═CH-CH2Cl+CH2═CH 2,
(4)通过以上分析知,E结构简式为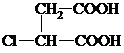
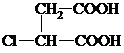
(5)有机化合物C有多种同分异构体,其中属于酯类且能发生银镜反应的所有同分异构体的结构简式为HCOOCH2CH2CH3、HCOOCH(CH3)2,
故答案为:HCOOCH2CH2CH3、HCOOCH(CH3)2.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确有机物官能团及其性质关系、物质之间的转化是解本题关键,知道每一步发生的反应及反应类型,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出248 kJ的热量 | B. | 吸收248 kJ的热量 | ||
| C. | 放出183 kJ的热量 | D. | 吸收183 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移(得失或偏移)的化学反应都是氧化还原反应 | |
| B. | p电子原子轨道的平均半径随电子层的增大而增大 | |
| C. | 电子是在原子核外,能量由低到高的不同电子层上分层排布的 | |
| D. | 氢原子电子云图中小黑点表示电子的运动轨迹 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液其PH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:填空题
【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4===2 KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=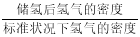 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度℃ | 450 | 500 | 550 | 600 |
| SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com