
钙在加热时能与氮气、氢气反应。氢化钙遇水立即反应生成氢氧化钙和氢气,氢化钙通常用氢气与金属钙加热制取,图1是横拟制取装置。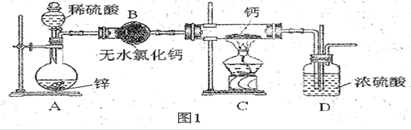
(1)用浓硫酸配制l:4(体积比)的稀硫酸,需用的玻璃仪器是烧杯、________。
(2)装置D中竖直导管的作用是________________________。
(3)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是_______。加热C装置前要对H2验纯,方法是:收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音,说明H2__________________________。
(4)甲同学认为只要装置合理、操作规范就可以排除生成__________(选填序号)。
a.Ca3N2 b.CaO c.Ca(OH)2
(5)乙同学用上图装置测定制得的氢化钙的纯度。他称取46 mg样品,与足量水反应,恒温时,注射器量出产生的气体为48.06 mL(已换算为标准状况)。产生实验误差的原因可能是_______(选填编号)。
①H2通入不足,反应器中有空气
②钙与H2未充分反应
③产物与空气接触
(6)丙同学根据乙同学的实验数据列了一个关系式,42x+40y=0.046、2x+y=48.06/22400请指出式子中y的含义___________________________________。
(1)玻璃棒、量筒(2分)
(2)平衡压强,防止液体倒流 (2分)
(3)无水硫酸铜(或其他合理答案)(1分);纯净(1分)
(4)a.b.c.(2分,答对2个就可以)
(5)①②(2分)
(6)钙的物质的量(2分)
解析试题分析:(1)用浓硫酸配制l:4(体积比)的稀硫酸,需用的玻璃仪器是烧杯、玻璃棒、量筒。
(2)装置D中竖直导管的作用是平衡压强,防止液体倒流 。
(3)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是无水硫酸铜,通过观察是否变成蓝色进行判断。加热C装置前要对H2验纯,方法是:收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音,说明H2纯净。
(4)钙能和空气中的氮气,氧气及水都可能会反应,分别生成 a.Ca3N2 b.CaOc.Ca(OH)2,故选abc。
(5)根据CaH2 + 2H2O = Ca(OH)2 + 2H2 。48.06 mL(已换算为标准状况)物质的量是0.002mol。CaH2的质量为0.084g,即84mg。结果偏大。①H2通入不足,反应器中有空气,可能会生成Ca3N2和CaO,Ca3N2 --- 2NH3,可能会使气体的量增大,结果偏大。②钙与H2未充分反应,必将会发生Ca---H2 ,也会使气体的量增大,结果偏大。③产物与空气接触后有部分气体放出,结果会偏小,错误;
(6)根据42,这是氢化钙的相对分子质量,40是钙的相对原子质量,可知42x+40y=0.046、2x+y=48.06/22400请指出式子中y的含义钙的物质的量。
考点:本题考查硫酸的稀释,物质的制备及原理分析,实验误差分析和计算。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:实验题
[实验化学]
对硝基苯甲酸在医药、感光材料等工业中应用广泛。以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242 ℃,沸点约359 ℃,微溶于水,能升华。)的反应原理为: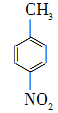 +Na2Cr2O7+4H2SO4―→
+Na2Cr2O7+4H2SO4―→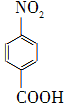 +Na2SO4+Cr2(SO4)3+5H2O
+Na2SO4+Cr2(SO4)3+5H2O
某小组以对硝基甲苯等物质为原料制取对硝基苯甲酸的实验装置如下图所示(加热和仪器固定装置均已略去),实验步骤如下:
步骤1:向250 mL三颈烧瓶中依次加入适量的对硝基甲苯、重铬酸钠粉末、水,并充分混合。在搅拌下,用滴液漏斗滴入适量浓硫酸后,加热0.5 h至反应液呈黑色。
步骤2:待反应混合物冷却后,和适量冰水充分混合,抽滤并用50 mL水分两次洗涤。将洗涤后的固体放入盛有适量5%硫酸溶液中,水浴加热10 min,冷却后抽滤。
步骤3:将抽滤后的固体溶于适量5%NaOH溶液中,50 ℃温热后抽滤,在滤液中加入少量活性炭,煮沸后趁热抽滤。将得到的滤液慢慢加入到盛有适量15%硫酸溶液的烧杯中,析出黄色沉淀,抽滤,冷水洗涤,干燥得粗产品。
(1) 在步骤1中“搅拌”是用电动搅拌器完成的,这样操作的好处有________、________。
(2) 在三颈烧瓶中,随着浓硫酸的加入,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是________。
(3) 在步骤2中,抽滤所得固体的主要成分是________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4) 步骤3用NaOH溶液进行处理的作用主要是____。
用NaOH溶液处理后,需50 ℃温热后抽滤的原因是____。
(5) 制得的粗产品需要进一步精制(纯化),根据对硝基苯甲酸的有关性质可知,对其进行精制(纯化)可以用乙醇溶液完成,也可以采用________法完成。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)已知:BaSO4(s)+4C(s) 高温4CO(g)+BaS(s)
工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
(1)若按以上流程在实验室焙烧重晶石矿,回收处理所产生的气体,恰当的方法是 (填字母编号)。
a.用澄清石灰水吸收气体 b.用浓硫酸吸收气体 c.点燃气体
(2)焙烧重晶石矿时,可能发生的副反应的化学方程式是 (写两个)。
(3)为测定产品氯化钡晶体(BaCl2·nH2O)中的n值,设计下列实验步骤,请补充完善空缺项的实验步骤:①称量样品;②灼烧样品;③置于 (填仪器名称)中冷却;④ ;⑤恒重操作。恒重操作的目的是 ;若最终测出的n值偏大,可能的实验操作误差原因是 (举例一种情况)。
(4)用下列装置组合也可完成(3)中实验。请选择下列恰当的装置组合(称量、加热和夹持仪器省略),完成上述实验: (用装置代号以“A
 ……
…… ”形式表示,每套装置不可重复使用)
”形式表示,每套装置不可重复使用)
(5)将重晶石矿与碳、氯化钙共同焙烧,可以直接得到氯化钡,反应的化学方程式为:
BaSO4+4C+CaCl2高温4CO +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
制备氮化镁的装置示意图如下: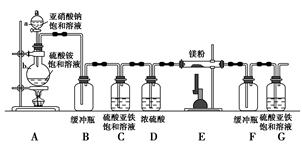
回答下列问题:
(1)检查装置气密性的方法是________________________________,
a的名称是________,b的名称是________;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式___________________;
(3)C的作用是______________________________________________________,
D的作用是____________________________________________________,
是否可以把C和D的位置对调并说明理由_____________________________;
(4)写出E中发生反应的化学方程式_________________________________;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下: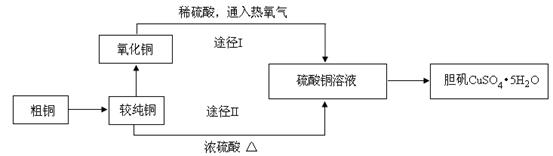
(1)“较纯铜”转化为氧化铜时,应将其置于 内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是 。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
① 。
② 。
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。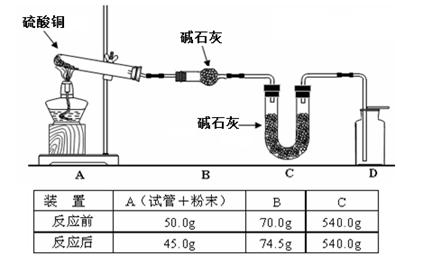
请通过计算,推断该实验条件下硫酸铜分解的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。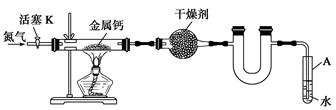
(1)反应过程中末端导管必须始终插入试管A的水中,目的是_____________________。
(2)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________________________________________________;
④拆除装置,取出产物。
(3)数据记录如下:(假设反应完全)
| 空硬质管质 量m0/g | 硬质管与钙的 质量m1/g | 硬质管与产物 的质量m2/g |
| 14.80 | 15.08 | 15.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生利用以下装置探究喷泉实验。其中A、F分别为硫化氢和氯气的发生装置,C为纯净干燥的氯气与硫化氢反应的装置。
请回答下列问题:
(1)装置F中发生反应的化学方程式 。
(2)装置A中的分液漏斗内液体a可选用 (选填以下选项的代号)
A.盐酸 B.浓硫酸 C.稀硫酸 D.稀硝酸
(3)虚线框内应添加必要的除杂装置,请从上图的“备选装置”中选择合适装置的编号,填入下列空格。B__________、D__________、E__________。
(4)打开K1、K2,将常温压下的H2S、Cl2以体积比1:1充满烧瓶后,烧瓶中发生的反应用化学方程式表示为 ;关闭K1、K2,始终看不到烧瓶内产生“喷泉”现象,理由是: 。
(5)在操作(4)的基础上,引发喷泉操作方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室以空气(O2体积分数20%)为原料,在无碳、无水的环境下,用下图A装置制备臭氧(3O2 2O3)。
2O3)。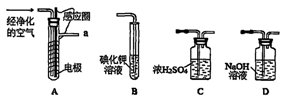
(1)空气通入A装置之前,应先后通过上述装置中的 、 (填装置序号)。
(2)臭氧与碘化钾溶液反应为:2KI+O3+H2O=2KOH+I2+O2。将a处气体通入装置B,溶液中的现象为 。
(3)为测定O2转化为O3的转化率,将装置B中的溶液全部转入另一容器中,加入CC14,经萃取、分液、蒸馏、冷却、称重,得I2固体0.254g。
①萃取操作所用玻璃仪器的名称 。
②若实验时通入空气1.12L(标准状况),O2的转化率为 。
③测定时需在A、B装置间连接装置D,原因是 。
(4)工业上分离O3和O2,可将混合气体液化后再分离,下列分离方法合理的是 (填序号)。
A.过滤 B.分馏 C.分液 D.萃取
(5)臭氧可用于含CN一碱性电镀废水的处理。第i步:CN一转化为OCN-;第ii步:OCN一继续转化为CO32一及两种单质气体。若第ii步转化时,O3与OCN-物质的质量之比为3∶2,该步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
采用下列装置和操作,能达到实验目的的是


甲 乙 丙 丁
| A.甲装置:加热浓硫酸和乙醇(其体积为比3∶1)混合液,制取乙烯 |
| B.乙装置:比较醋酸、碳酸、苯酚三者的酸性强弱 |
| C.丙装置:向混有苯酚的苯中加入NaOH溶液,除去其中的苯酚 |
| D.丁装置:A中为乙醇、醋酸,B为饱和碳酸钠溶液,制取乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com