
对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是()
A. 以石墨为电极,电解含甲基橙的0.1 mol/L硫酸溶液
B. 以铜为电极,电解1 mol/L硫酸溶液
C. 以石墨为电极,电解含酚酞的饱和食盐水
D. 以石墨为电极,电解1 mol/L溴化钾溶液
考点: 电解原理.
专题: 电化学专题.
分析: A、硫酸溶液在甲基橙溶液中呈红色,电解硫酸溶液实质电解水,硫酸浓度增大,溶液红色无明显变化;
B、铜在阳极失电子生成铜离子使溶液呈蓝色;
C、电解饱和食盐水阴极附近氢离子得到电子生成氢气,附近氢氧根离子浓度增大遇到酚酞变红;
D、电解溴化钾溶液过程中生成溴单质,溶液呈橙色.
解答: 解:A、硫酸溶液在甲基橙溶液中呈红色,电解硫酸溶液实质电解水,硫酸浓度增大,溶液红色无明显变化,故A符合;
B、铜在阳极失电子生成铜离子,使溶液呈蓝色,溶液颜色发生变化,故B不符合;
C、电解饱和食盐水阴极附近氢离子得到电子生成氢气,附近氢氧根离子浓度增大遇到酚酞变红,溶液颜色发生变化,故C不符合;
D、电解溴化钾溶液过程中生成溴单质,溴溶于水溶液呈橙色,溶液颜色变化,故D不符合;
故选A.
点评: 本题考查了电解原理的分析应用,注意生成产物性质的分析,指示剂变色的原理应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:
在常压和500℃条件下,等物质的量的Ag2O,Fe(OH)3 ,NH4HCO3 ,NaHCO3完全分解,所得气体体积依次是V1\V2\V3\V4.体积大小顺序正确的是
A.V3>V2>V4>V1 B. V3>V4>V2>V1
C.V3>V2>V1>V4 D.V2>V3>V1>V4
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:
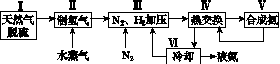
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
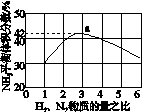

(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
38.4 mg铜跟适量的浓硝酸反应,铜全部反应后,共收集到气体22.4 mL(标准状况),反应消耗的HNO3的物质的量可能是( )
A.1.0×10-3 mol B.1.6×10-3 mol C.2.2×10-3 mol D.2.4×10-3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是()
A. 4Fe(OH)2+2H2O+O2═4Fe(OH)3 B. 2Fe+2H2O+O2═2Fe(OH)2
C. 2H2O+O2+4e﹣═4OH﹣ D. Fe﹣3e﹣═Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
将一直流电源的正、负极,用玻璃片分别压在一张用食盐水、碘化钾淀粉溶液和石蕊试液浸透的滤纸上,经过一段时间后,两极附近滤纸的颜色分别是()
A B C D
阳极 蓝 白 红 蓝
阴极 白 蓝 蓝 蓝
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原
反应的化学方程式:__________________、__________________。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一 定比例加入氨水或碳酸
氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原
因可能是______________;②析出的晶体可用于造纸工业,也可用于照相用
显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,20.00 mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466 g沉淀。滤液跟2 mol·L-1 NaOH溶液反应,共用去10.00 mL碱液时恰好中和。下列说法中不正确的是( )
A.原混合液中c(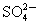 )=0.1 mol·L-1
)=0.1 mol·L-1
B.原混合液中c(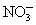 )=0.9 mol·L-1
)=0.9 mol·L-1
C.原混合液中pH=0
D.原混合液中由水电离出的c(H+)=10-14 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com