
| 5.6L |
| 22.4L/mol |
| 0.25mol×2 |
| 3 |
| 1 |
| 6 |
| 1 |
| 6 |
| 4.5g |
| 5.0g |
| 0.5g |
| 24g/mol |
| 1 |
| 48 |
| 1 |
| 6 |
| 1 |
| 48 |


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
| A、K+、CO32-、Ag+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、NO3-、Na+、MnO4-、K+ |
| D、Ca2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.4 mL |
| B、5.6 mL |
| C、4.2 mL |
| D、2.8 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
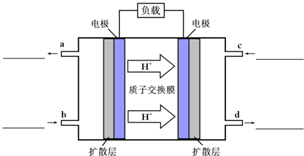 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+| 3 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com